Kinesinové motorové proteiny: Dynamické motory pohánějící intracelulární logistiku. Objevte, jak tyto molekulární stroje revolucionalizují buněčné funkce a zdraví.
- Úvod do kinesinových motorových proteinů
- Molekulární struktura a mechanismus účinku
- Hydrolýza ATP a konverze energie
- Rozpoznávání nákladu a specifita vazby
- Intracelulární transportní dráhy
- Regulace aktivity kinesinů
- Kinesin v neuronálních funkcích a axonálním transportu
- Komparativní analýza: Kinesin vs. dynein a myosin
- Nemoci související s kinesiny a terapeutické cíle
- Vznikající výzkum a budoucí směry
- Zdroje a reference
Úvod do kinesinových motorových proteinů
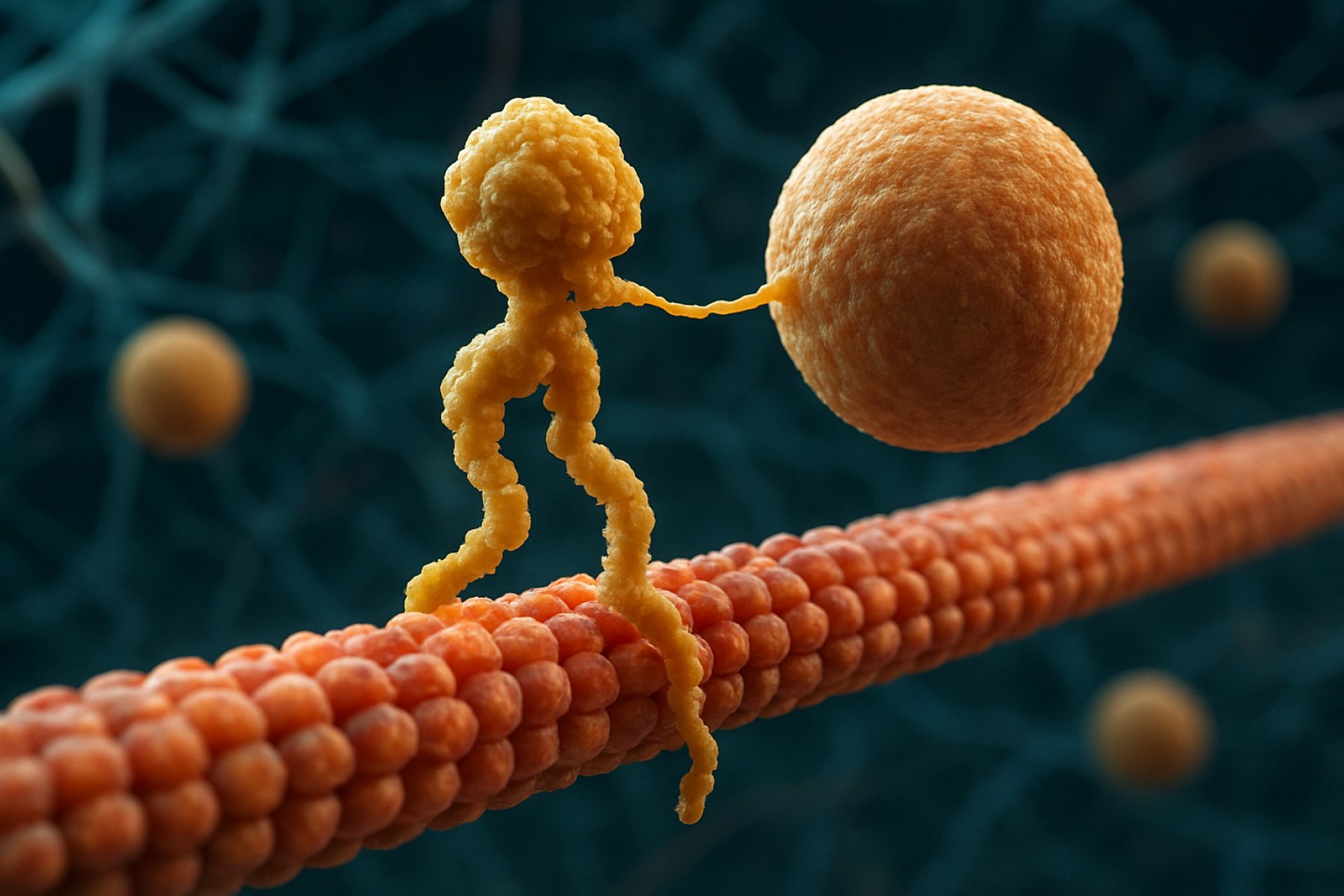
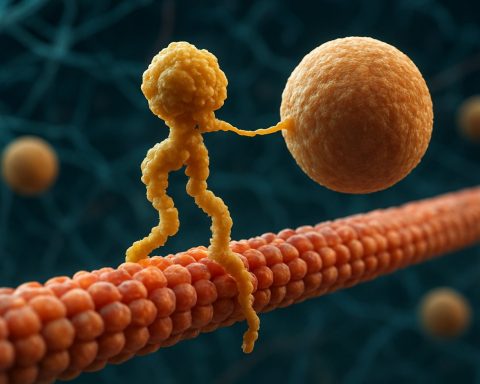
Kinesinové motorové proteiny jsou základní třídou molekulárních motorů, které hrají klíčovou roli v intracelulárním transportu a buněčné organizaci. Objeveny byly v polovině 80. let, kinesiny jsou ATP-závislé proteiny, které se pohybují po mikrotubulových trasách uvnitř eukaryotických buněk a transportují různé náklady, jako jsou organely, vezikuly, proteiny a mRNA. Tento transport je nezbytný pro řadu buněčných procesů, včetně mitózy, meiózy a neuronálních funkcí. Superfamilii kinesinů tvoří více než 40 různých kinesinových genů, které byly identifikovány u lidí, z nichž každý kóduje proteiny s specializovanými funkcemi a specifikacemi nákladu.
Strukturálně se kinesiny obvykle skládají ze dvou těžkých řetězců a dvou lehkých řetězců. Těžké řetězce obsahují konzervovaný motorový domén, který se váže na mikrotubuly a hydrolyzuje ATP k generování pohybu. Ocasní domény kinesinů jsou odpovědné za vazbu nákladu, což umožňuje motoru transportovat specifické buněčné komponenty na jejich určená místa. Pohyb kinesinu je obecně směřován k pozitivnímu konci mikrotubulů, což obvykle odpovídá periférii buňky, ačkoli někteří členové rodiny kinesinů se pohybují k negativnímu konci.
Mechanismus pohybu kinesinů je často popisován jako pohyb „ruku v ruce“, kde se dva motorové domény střídavě vážou a uvolňují mikrotubul, poháněny cykly vazby ATP a hydrolyzace. Tento procesivní pohyb umožňuje kinesinům cestovat dlouhé vzdálenosti po mikrotubulech, aniž by se odpojily, což je činí vysoce efektivními transportéry v přeplněném buněčném prostředí. Přesná regulace aktivity kinesinů je nezbytná pro udržení buněčné homeostázy a funkce.
Kinesinové motorové proteiny jsou nejen zásadní pro normální buněčné operace, ale také souvisí s různými nemocemi. Defekty v funkci kinesinů byly spojeny s neurodegenerativními poruchami, jako je Alzheimerova choroba a dědičná spastická paraplegie, stejně jako s některými rakovinami. V důsledku toho jsou kinesiny předmětem intenzivního výzkumu, jak pro pochopení jejich základní biologie, tak pro prozkoumání jejich potenciálu jako terapeutických cílů.
Výzkum kinesinových motorových proteinů je podporován a rozvíjen předními vědeckými organizacemi a výzkumnými institucemi po celém světě, včetně Národních institutů zdraví a Národní vydavatelské skupiny, které pravidelně publikují recenzované studie o struktuře, funkci a biomedicínském významu těchto proteinů. Pokračující studium kinesinů nadále odhaluje nové poznatky o molekulárním strojním zařízení života a nabízí slibné cesty pro vývoj nových medicínských intervencí.
Molekulární struktura a mechanismus účinku
Kinesinové motorové proteiny jsou superfamilie ATP-závislých molekulárních motorů, které hrají rozhodující roli v intracelulárním transportu, zejména podél mikrotubulových tras. Strukturálně se kinesiny obvykle skládají ze dvou těžkých řetězců a dvou lehkých řetězců, čímž vytvářejí heterotetramerový komplex. Těžké řetězce obsahují vysoce konzervovaný N-terminální motorový domén (také nazývaný „hlava“), stočenou stopku a C-terminální ocasní domén. Motorová doména je odpovědná za vazbu na mikrotubuly a hydrolyzu ATP, která poskytuje energii potřebnou pro pohyb. Ocasní doména naopak působí při rozpoznávání a vazbě nákladu, často interaguje s adaptačními proteiny nebo přímo s vezikuly a organelami.
Mechanismus účinku kinesinových motorových proteinů je často popisován jako „pohyb ruku v ruce“. Každá molekula kinesinu má dvě motorové domény, které se střídavě vážou a uvolňují od mikrotubulu, koordinovány vazbou ATP a hydrolyzací. Když jedna hlava se váže na mikrotubul a hydrolyzuje ATP, dochází k konformační změně, která posune druhou hlavu vpřed k dalšímu vazebnímu místu, přibližně 8 nanometrů daleko. Tento proces se opakuje, což umožňuje kinesinu „chodit“ jednoběžně podél mikrotubulu, obvykle směrem k pozitivnímu konci, který je orientován k periferii buňky. Koordinované působení obou hlav zajišťuje procesivitu, což znamená, že kinesin může vykonat mnoho kroků podél mikrotubulu, aniž by se odpojil, což je zásadní pro efektivní transport nákladu na dlouhé vzdálenosti uvnitř buňky.
Kinesiny jsou vysoce rozmanité, s více než 40 různými kinesinovými geny identifikovanými u lidí, z nichž každý je přizpůsoben specifickým buněčným funkcím. Zatímco většina kinesinů se pohybuje směrem k pozitivnímu konci mikrotubulu, některé, jako příslušníci rodiny kinesin-14, se pohybují směrem k negativnímu konci, což ukazuje na funkční vielseitnost této proteinové rodiny. Aktivita a směrovost kinesinů jsou určovány jemnými rozdíly v jejich motorových doménách a souvisejících regulačních oblastech.
Studie struktury a funkce kinesinů byly pokročily díky vysoce rozlišovacím technikám, jako je rentgenová krystalografie a kryoelektronová mikroskopie, které odhalily podrobné poznatky o konformačních změnách, které leží za jejich pohybem. Tyto závěry byly zásadní pro pochopení nejen základní buněčné biologie, ale také molekulárního základu nemocí spojených s dysfunkcí kinesinů, jako jsou některé neurodegenerativní poruchy a rakoviny. Přední výzkumné organizace, včetně Národních institutů zdraví a Evropského molekulárního biologického laboratoře, nadále zkoumá molekulární mechanismy kinesinových motorových proteinů, což podtrhuje jejich základní význam v buněčné biologii.
Hydrolýza ATP a konverze energie
Kinesinové motorové proteiny jsou nezbytné molekulární stroje, které přetvářejí chemickou energii na mechanickou práci, což umožňuje transport různých buněčných nákladů podél mikrotubulů. Základním procesem, který tento pohyb podporuje, je hydrolyza adenosintrifosfátu (ATP), která poskytuje energii potřebnou pro konformační změny kinesinu a směrovou motilitu.
Hydrolýza ATP probíhá na motorových doménách (také nazývaných „hlavy“) dimeru kinesinu. Každá hlava obsahuje vysoce konzervované místo pro vazbu nukleotidů, které střídavě váže a hydrolyzuje ATP. Mechano-chemický cyklus začíná, když jedna hlava kinesinu, pevně vázaná na mikrotubul, váže ATP. Tato vazba vyvolá konformační změnu v oblasti krčku, která posune zadní hlavu vpřed v pohybu „ruku v ruce“. Jakmile se vedoucí hlava váže na další tubulinovou podjednotku, ATP je hydrolyzováno na adenosindifosfát (ADP) a anorganický fosfát (Pi), přičemž se uvolňuje energie, která je přetvářena na mechanický pohyb. Uvolnění Pi a následná výměna ADP za ATP resetují cyklus, což umožňuje kontinuální procesivní pohyb podél mikrotubulu.
Účinnost konverze energie v kinesinu je pozoruhodná. Každá hydrolyzovaná molekula ATP způsobí krok o 8 nanometrů podél mikrotubulu s minimální ztrátou energie. Tato vysoká účinnost je přičítána těsnému spojení mezi hydrolyzou ATP a mechanickým krokovacím mechanismem. Proces je vysoce regulován, což zajišťuje, že hydrolyza ATP probíhá pouze tehdy, když je hlava kinesinu správně zapojena do mikrotubulu, čímž se zabraňuje plýtvání energií.
ATPázová aktivita kinesinu je také modulována přítomností nákladu a specifickým typem člena rodiny kinesinů, který je zapojen. Například konvenční kinesin-1 je vysoce procesivní, schopný udělat stovky kroků bez odpojení od mikrotubulu, zatímco jiní členové rodiny kinesinů mohou mít různé míry hydrolyzy ATP a chování při krokování, přizpůsobené jejich buněčným funkcím.
Studie hydrolyzy ATP a konverze energie v kinesinu byly zásadní pro pochopení intracelulárních transportních mechanismů a širších principů funkce molekulárních motorů. Výzkum v této oblasti je podporován předními vědeckými organizacemi, jako jsou Národní instituty zdraví a Národní vědecká nadace, které financují vyšetřování struktury a biophysiky motorových proteinů. Poznatky získané z těchto studií mají důsledky pro neurobiologii, buněčné dělení a vývoj nanotechnologických aplikací, které napodobují biologické motory.
Rozpoznávání nákladu a specifita vazby
Kinesinové motorové proteiny jsou nezbytné molekulární stroje, které transportují širokou škálu intracelulárních nákladů podél mikrotubulových tras, hrající klíčovou roli v procesech, jako je umístění organel, transport vezikul a mitóza. Specifita, s jakou kinesiny rozpoznávají a vážou se na svůj náklad, je zásadní pro věrnost a regulaci intracelulárního transportu. Tato specifita je dosažena kombinací strukturálních rysů, adaptačních proteinů a regulačních mechanismů.
Superfamilie kinesinů je charakterizována konzervovaným motorovým doménem odpovědným za hydrolýzu ATP a vazbu na mikrotubuly, ale funkce rozpoznávání a vazby nákladu jsou primárně zprostředkovány proměnlivými ocasními doménami. Tyto ocasní oblasti se mezi jednotlivými členy rodiny kinesinů výrazně liší, což umožňuje selektivní interakci s různými náklady. Například kinesin-1 (také známý jako konvenční kinesin) využívá svou C-terminální ocas tu k vazbě na různé náklady, včetně organel spojených s membránou a vezikul, často prostřednictvím adaptačních proteinů, jako jsou lehké řetězce kinesinů (KLC). KLC obsahují tetratrikopeptidové opakující se (TPR) motivy, které usnadňují rozpoznání specifických proteinů spojených s nákladem, čímž udělují selektivitu transportnímu procesu.
Adaptační proteiny hrají zásadní roli v propojení kinesinů s jejich náklady. Tyto adaptory mohou rozpoznávat specifické signály nebo motivy na povrchu nákladu, čímž zajišťují, že pouze odpovídající náklad je transportován daným kinesinem. Například interakce mezi KLC a členy rodiny JIP (proteiny interagující s c-Jun N-terminální kinázou) je dobře zdokumentována v neuronálním transportu, kde JIPs fungují jako lešení propojující kinesin-1 s vezikuly obsahujícími signální molekuly. Jiné členy rodiny kinesinů, jako je kinesin-3, využívají k dosažení specifity nákladu různé adaptory a struktury ocasních domén, což odráží rozmanitost nákladů a buněčných kontextů, v nichž kinesiny působí.
Regulace vazby nákladu je dosažena také prostřednictvím posttranslačních модифikací a konkurenceschopných interakcí. Fosforylace ocasních sekvencí kinesinů nebo adaptačních proteinů může modulovat vazebnou afinitu, což umožňuje dynamickou kontrolu nad připojením a uvolněním nákladu v reakci na buněčné signály. Navíc se některé náklady mohou ucházet o vazbu na stejný kinesin, což zavádí další vrstvu regulace, která zajišťuje správnou distribuci nákladu.
Studie rozpoznávání nákladu a specifity vazby u kinesinových motorových proteinů je rychle se vyvíjející obor, s důsledky pro porozumění neurodegenerativním onemocněním, poruchám intracelulárního transportu a vývoji cílených terapeutik. Přední výzkumné organizace, jako jsou Národní instituty zdraví a Evropská molekulární biologická organizace, podporují pokračující vyšetřování molekulárních mechanismů, jež leží pod interakcemi kinesin-náklad, což podtrhuje biomedicínský význam této oblasti.
Intracelulární transportní dráhy
Kinesinové motorové proteiny jsou nezbytné molekulární stroje, které pohánějí intracelulární transport podél mikrotubulových tras, zajišťují přesné dodání organel, vezikul, proteinů a jiných nákladů uvnitř eukaryotických buněk. Tyto ATP-závislé motory se vyznačují svojí schopností přetvářet chemickou energii na mechanickou práci, usnadňují pohyb buněčných komponent přes dlouhé vzdálenosti s pozoruhodnou směrovostí a specifikací.
Strukturálně se kinesiny obvykle skládají ze dvou těžkých řetězců tvořících dimer, každá s globulární motorovou doménou (hlava), která se váže na mikrotubuly a hydrolyzuje ATP. Ocasní domény jsou odpovědné za rozpoznávání a vazbu nákladu, často v asociaci s lehkými řetězci nebo adaptačními proteiny. Nejlépe prozkoumaný člen, kinesin-1, se pohybuje převážně směrem k pozitivnímu konci mikrotubulů, což obecně odpovídá periferii buňky, a tak hraje klíčovou roli v anterogradním transportu.
Mechanismus pohybu kinesinů je často popisován jako pohyb „ruku v ruce“, kdy se dvě motorové domény střídavě vážou a kráčejí podél mřížky mikrotubulu. Každý krok je úzce spojen s hydrolyzou jediné molekuly ATP, což zajišťuje procesivitu a směrovost. Tento koordinovaný pohyb umožňuje kinesinům transportovat náklady na vzdálenosti, které mohou překročit celou délku neuronu nebo jiných velkých buněčných typů.
Kinesiny jsou klasifikovány do několika rodin na základě sekvenční homologie a funkční specializace. Zatímco kinesin-1 se primárně podílí na transportu organel a vezikul, jiné rodiny, jako kinesin-2 a kinesin-3, mají odlišné úlohy v ciliárním transportu a trafficking synaptických vezikul. Někteří kinesiny, jako kinesin-5, se podílejí na dynamice mitotického vřeténka spíše než na transportu nákladu, což ukazuje na funkční rozmanitost v rámci této proteinové superrodiny.
Aktivita kinesinových motorů je přísně regulována buněčnými signálními dráhami, posttranslačními modifikacemi a interakcemi s mikrotubuly asociovanými proteiny. Tato regulace zajišťuje, že náklady jsou dodávány na správná subcellulární místa v reakci na fyziologické potřeby. Porušení transportu zprostředkovaného kinesiny bylo spojeno s různými onemocněními, včetně neurodegenerativních poruch, kde defektní axonální transport přispívá k neuronální dysfunkci a degeneraci.
Výzkum kinesinových motorových proteinů pokračuje v prohlubování našeho chápání buněčné logistiky a inspiroval vývoj biomimetických nan zařízení. Přední vědecké organizace, jako jsou Národní instituty zdraví a Národní vydavatelská skupina, pravidelně publikují základní studie a přehledy o struktuře, funkci a biomedicínském významu kinesinů, což podtrhuje jejich centrální roli v buněčné biologii.
Regulace aktivity kinesinů
Kinesinové motorové proteiny jsou nezbytné molekulární stroje, které transportují náklad podél mikrotubulů uvnitř eukaryotických buněk. Regulace aktivity kinesinů je klíčová pro udržení buněčné organizace, zajištění správné distribuce organel a podporu procesů, jako jsou mitóza a neuronální funkce. Existuje několik vrstev regulace, které kontrolují, kdy, kde a jak se kinesiny interagují se svým nákladem a dráhami mikrotubulů.
Jedním z hlavních mechanismů regulace je autoinhibice. Mnoho členů rodiny kinesinů, jako je kinesin-1, má ocasní domény, které se mohou ohýbat zpět a interagovat se svými motorovými doménami, čímž brání aktivitě ATPázy a vazbě na mikrotubuly v nepřítomnosti nákladu. Tato autoinhibovaná konformace se uvolňuje po vazbě nákladu, což vyvolává konformační změnu, která aktivuje motor pro procesivní pohyb. Tento mechanismus zajišťuje, že kinesiny jsou aktivní pouze tehdy, když je potřeba, a zabraňuje zbytečné spotřebě ATP a potenciálnímu poškození buněk.
Posttranslační modifikace (PTM) také hrají významnou roli při modulaci aktivity kinesinů. Fosforylace je nejpodrobněji studovaná PTM, přičemž kinázy, jako jsou cyklin-dependentní kinázy (CDK) a glykogen syntázová kináza 3 (GSK3), fosforylují specifické residua na protein těchto kinesinů. Tyto modifikace mohou buď zvyšovat, nebo inhibovat motorickou aktivitu v závislosti na kontextu a konkrétním kinesinu. Například fosforylace kinesinu-1 GSK3 inhibuje jeho schopnost vázat se na mikrotubuly, čímž reguluje axonální transport v neuronech.
Proteiny adaptéry dále zpřesňují regulaci kinesinů. Tyto adaptory, jako JIP1 a Milton, spojují kinesiny s konkrétními náklady a mohou modulovat motorickou aktivitu stabilizací aktivní konformace nebo přitahováním dalších regulačních faktorů. Interakce mezi adaptory a motory umožňují přesnou prostorovou a časovou kontrolu dodávky nákladu, což je zvlášť kritické v silně polarizovaných buňkách, jako jsou neurony.
Kromě toho mohou samotné mikrotubulové dráhy ovlivnit aktivitu kinesinů. Proteiny asociované s mikrotubuly (MAP) a post-translační modifikace tubulinu (jako acetylace nebo detyrosinace) mohou měnit vazebné afinity a motilitu kinesinů, efektivně řídit nebo omezovat jejich pohyb podél specifických subsetů mikrotubulů.
Regulace motorových proteinů kinesinu je předmětem aktuálního výzkumu, s důsledky pro chápání neurodegenerativních onemocnění, rakoviny a vývojových poruch. Přední organizace, jako jsou Národní instituty zdraví a Národní vydavatelská skupina, podporují a publikují výzkum v této oblasti, což podtrhuje důležitost regulace kinesinů ve zdraví a nemoci.
Kinesin v neuronálních funkcích a axonálním transportu
Kinesinové motorové proteiny jsou superrodina ATP-závislých molekulárních motorů, které hrají klíčovou roli v intracelulárním transportu, zejména v vysoce polarizovaném prostředí neuronů. Tyto proteiny se pohybují podél mikrotubulových tras, přetvářejí chemickou energii z hydrolyzy ATP na mechanickou práci, což umožňuje směrovaný pohyb různých buněčných nákladů. V neuronech jsou kinesiny nezbytné pro transport organel, prekurzorů synaptických vezikul, proteinů a mRNA z buněčného těla (somy) k axonálnímu terminálu, což je proces známý jako anterogradní axonální transport.
Superfamilie kinesinů je rozmanitá a obsahuje více než 40 různých kinesinových genů identifikovaných u lidí, z nichž každý kóduje proteiny s specializovanými funkcemi a specifikacemi nákladu. Nejlépe prozkoumaný člen, kinesin-1 (také známý jako konvenční kinesin), je heterotetramer složený ze dvou těžkých řetězců a dvou lehkých řetězců. Těžké řetězce obsahují motorové domény odpovědné za hydrolyzu ATP a vazbu na mikrotubuly, zatímco lehké řetězce zprostředkovávají rozpoznávání a vazbu nákladu. Tato strukturální organizace umožňuje kinesinu-1 transportovat širokou škálu nákladů, které jsou pro neuronální funkci a přežití kritické.
Axonální transport je zásadní pro udržení zdraví a funkce neuronů, vzhledem k extrémní délce některých axonů, která může dosáhnout až jednoho metru u lidí. Kinesin-driven anterogradní transport zaručuje včasné dodání synaptických komponentů, mitochondrií a dalších nezbytných organel do distálních oblastí neuronu. Porucha funkce kinesinů může vést k deficitům v synaptickém přenosu, axonální degeneraci a byla implikována v několika neurodegenerativních onemocněních, včetně Alzheimerovy choroby a amyotrofické laterální sklerózy (ALS). Význam transportu zprostředkovaného kinesiny pro zdraví neuronů je podtržen výzkumem předních vědeckých organizací, jako jsou Národní instituty zdraví a Národní institut neurologických poruch a mrtvice, které zvýraznily spojení mezi vadami axonálního transportu a neurodegenerací.
Kromě anterogradního transportu koordinují kinesiny také s dyneinovými motorovými proteiny, které zprostředkovávají retrogradní transport (z axonálního terminálu zpět k somě), aby udržely obousměrný tok materiálů nezbytný pro neuronální homeostázu. Přesná regulace aktivity kinesinů, výběru nákladu a koordinace s dalšími motorovými proteiny je předmětem pokračujícího výzkumu, s důsledky pro pochopení molekulárních základů neuronální konektivity, plasticity a nemocí.
Komparativní analýza: Kinesin vs. dynein a myosin
Kinesinové motorové proteiny jsou základní třídou molekulárních motorů, které hrají klíčovou roli v intracelulárním transportu, zejména podél mikrotubulových tras. Abychom plně ocenili jejich biologický význam, je zásadní porovnat kinesiny s dalšími dvěma hlavními rodinami cytoskeletálních motorových proteinů: dyneiny a myosiny. Každý z těchto motorových proteinů je specializován pro pohyb podél odlišných cytoskeletálních filament a je přizpůsoben specifickým buněčným funkcím.
Kinesiny a dyneiny obě překonávají mikrotubuly, ale liší se ve své směrovosti a specifitě nákladu. Kinesiny se obvykle pohybují směrem k pozitivnímu konci mikrotubulů, což je obvykle orientováno směrem k periferii buňky, čímž usnadňují anterogradní transport organel, vezikul a proteinových komplexů. Naopak dyneiny se pohybují směrem k negativnímu konci mikrotubulů, nasměrovávajíce náklad směrem k centru buňky, jako je jádro nebo centrum organizace mikrotubulů. Tento obousměrný systém zajišťuje efektivní distribuci a recyklaci buněčných komponentů. Strukturálně jsou kinesiny obvykle homodimerické nebo heterodimerické proteiny se dvěma motorovými doménami, zatímco cytoplazmatické dyneiny jsou velké, multi-subunitní komplexy s složitějším mechanismem generování a regulace síly (Národní institut genetiky).
Myosiny, na druhou stranu, jsou primárně proteiny motorů založené na aktonu. Jsou nejlépe známé pro svou roli při svalové kontrakci, ale také se podílejí na různých procesech, které neobsahují svaly, jako je cytokineze, transport vezikul a buněčná motilita. Na rozdíl od kinesinů a dyneinů, které se pohybují podél mikrotubulů, myosiny překonávají aktinová vlákna, obvykle směrem k pozitivnímu (hrotovému) konci. Strukturální uspořádání myosinů je odlišné, s charakteristickou hlava doménou, která váže akton a hydrolyzuje ATP, krček a ocas, který určuje specifitu nákladu (Národní instituty zdraví).
Funkčně jsou tyto tři rodiny motorových proteinů přizpůsobeny svým příslušným cytoskeletálním dráhám a buněčným rolím. Kinesiny jsou nezbytné pro dlouhodobý, směrový transport v neuronech a dělících se buňkách, zatímco dyneiny jsou nezbytné pro retrogradní transport a ciliární/flagelární pohyb. Myosiny, naopak, jsou centrální pro procesy vyžadující generování síly a krátkodobý transport na aktonových sítích. Interakce mezi těmito motory zajišťuje dynamickou organizaci a přizpůsobivost eukaryotické buňky.
Shrnuto, zatímco kinesiny, dyneiny a myosiny sdílejí základní vlastnost přetváření chemické energie z hydrolyzy ATP na mechanickou práci, jsou specializovány na různé dráhy, směry a buněčné funkce. Jejich koordinovaná činnost je životně důležitá pro udržení buněčné architektury, signalizace a homeostázy.
Nemoci související s kinesiny a terapeutické cíle
Kinesinové motorové proteiny jsou nezbytné molekulární stroje, které transportují různé buněčné náklady podél mikrotubulů, hrající klíčovou roli v intracelulárním trafficking, mitóze a neuronálních funkcích. Dysregulace nebo mutace kinesinových genů byly spojeny s řadou lidských chorob, což činí tyto proteiny významnými jak jako biomarkery, tak jako potenciální terapeutické cíle.
Jedno z nejlépe zdokumentovaných asociací nemocí zahrnuje člena rodiny kinesinů KIF1A. Mutace v genu KIF1A jsou spojeny se spektrem neurodegenerativních poruch, souhrnně známých jako KIF1A-asociovaná neurologická porucha (KAND). Tyto stavy se manifestují jako intelektuální postižení, spastická paraplegie a progresivní neurodegenerace. Podkladová patologie je často přičítána poškození axonálního transportu, což narušuje synaptickou funkci a přežití neuronů. Podobně mutace v jiných kinesinových genech, jako KIF5A a KIF21A, jsou spojeny s dědičnou spastickou paraplegií a kongenitální fibrosou extraokulárních svalů, což dále zdůrazňuje kritickou roli kinesinů ve zdraví nervového systému.
Kromě neurodegenerace jsou kinesinové motorové proteiny také spojeny s rakovinou. Například KIF11 (také známý jako Eg5) je nezbytný pro vytvoření mitotického vřeténka během buněčného dělení. Overexprese nebo hyperaktivita KIF11 byla pozorována v různých rakovinách, včetně rakoviny prsu a prostaty, kde přispívá k nekontrolované proliferaci buněk. V důsledku toho se KIF11 stal slibným cílem pro antimitotické rakovinné terapie. Několik inhibitorů malé molekuly KIF11, jako ispinesib, vstoupilo do klinických zkoušek a snaží se selektivně narušit dělení rakovinných buněk, při zachování normálních buněk. Vývoj a hodnocení těchto inhibitorů jsou pečlivě sledovány regulačními a výzkumnými organizacemi, jako je Národní institut rakoviny a Úřad pro potraviny a léky v USA.
Terapeutické strategie cílení na kinesinové motorové proteiny přesahují onkologii. V neurodegenerativních onemocněních probíhají snahy vyvinout molekuly, které mohou obnovit nebo modifikovat funkci kinesinů, což by potenciálně zmírnilo deficity axonálního transportu. Dále zkoumání, podpořená organizacemi jako Národní instituty zdraví, se zabývá genovou terapií a přístupy s malými molekulami k nápravě nebo kompenzaci defektní aktivity kinesinů u genetických poruch.
Shrnuto, kinesinové motorové proteiny jsou klíčové pro buněčné zdraví a jejich dysfunkce je spojena s různými onemocněními, zejména v nervovém systému a při rakovině. Pokračující výzkum a klinické vývojové úsilí nadále zkoumá kinesiny jako biomarkery i terapeutické cíle, což má potenciál přinést nové léčby pro aktuálně neřešitelné stavy.
Vznikající výzkum a budoucí směry
Vznikající výzkum na kinesinových motorových proteinech rychle rozšiřuje naše chápání jejich rolí v buněčných procesech a jejich potenciálních aplikací v biotechnologii a medicíně. Kinesiny jsou superfamilie ATP-závislých molekulárních motorů, které transportují náklad podél mikrotubulů, hrající zásadní roli v intracelulárním trafficking, mitóze a neuronálních funkcích. Naposledy dosažené pokroky v zobrazování s vysokým rozlišením a biophysice jednotlivých molekul umožnily výzkumníkům vizualizovat dynamiku kinesinů v bezprecedentních detailech, odhalujíce nové poznatky o jejich mechanicko-chemických cyklech a regulačních mechanismech.
Jedním z slibných směrů zahrnuje objasnění strukturální rozmanitosti kinesinů a její dopady na specifitu nákladu a regulaci. Techniky strukturální biologie, jako je kryoelektronová mikroskopie, odhalily různé konformační stavy členů rodiny kinesinů, což naznačuje specializované adaptace pro různé buněčné úkoly. Tyto strukturální znalosti informují návrh malých molekul a peptidů, které mohou modulovat aktivitu kinesinů, s potenciálními terapeutickými aplikacemi u neurodegenerativních onemocnění a rakoviny, u nichž je abnormální funkce kinesinů implikována v patogenezi.
Syntetická biologie také využívá kinesinové motory k navržení nanoskalových transportních systémů. Využitím směrového pohybu kinesinů vyvíjejí výzkumníci biomimetické zařízení pro cílené dodávání léků a molekulární montáž. Tyto inovace by mohly revolucionalizovat precizní medicínu, umožňující kontrolované transporty terapeutických látek uvnitř buněk nebo tkání.
Další vznikající oblastí je studium role kinesinů v neuronálním zdraví a nemoci. Mutace v kinesinových genech byly spojeny s dědičnou spastickou paraplegií, Charcot-Marie-Toothovou nemocí a dalšími neurodegenerativními poruchami. Pokračující výzkum je zaměřen na objasnění, jak tyto mutace narušují axonální transport a na identifikaci strategií pro obnovu normální funkce. Národní instituty zdraví a Národní institut neurologických poruch a mrtvice podporují iniciativy k prozkoumání molekulárních základů těchto onemocnění a k vývoji cílených intervencí.
Do budoucna se očekává, že integrace výpočetního modelování, pokročilé mikroskopie a technologií editace genomu urychlí objevy v biologii kinesinů. Spolupráce mezi akademickými institucemi, vládními agenturami a biotechnologickými společnostmi podněcuje převedení základního výzkumu do klinických a průmyslových aplikací. Jak se naše chápání kinesinových motorových proteinů prohlubuje, objevují se nové příležitosti k manipulaci s intracelulárním transportem, diagnostice nemocí a navrhování inovativních terapeutických strategií.
Zdroje a reference
- Národní instituty zdraví
- Národní vydavatelská skupina
- Evropské molekulární biologické laboratoře
- Národní vědecká nadace
- Evropská molekulární biologická organizace
- Národní institut genetiky
- Národní institut rakoviny