Kinesin Motor Proteiner: De Dynamiske Motorer, der Driver Intracellulær Logistik. Oplev, hvordan disse molekylære maskiner revolutionerer cellulær funktion og sundhed.
- Introduktion til Kinesin Motor Proteiner
- Molekylær Struktur og Handlingsmekanisme
- ATP Hydrolyse og Energikonversion
- Lastgenkendelse og Binding Specificitet
- Intracellulære Transportveje
- Regulering af Kinesin Aktivitet
- Kinesin i Neuronal Funktion og Axonal Transport
- Sammenlignende Analyse: Kinesin vs. Dynein og Myosin
- Kinesin-Relaterede Sygdomme og Terapeutiske Mål
- Ny Forskning og Fremtidige Retninger
- Kilder & Referencer
Introduktion til Kinesin Motor Proteiner
Kinesin motor proteiner er en grundlæggende klasse af molekylære motorer, der spiller en kritisk rolle i intracellulær transport og cellulær organisering. Opdaget i midten af 1980’erne, er kinesiner ATP-afhængige proteiner, der bevæger sig langs mikrotubulebaner i eukaryote celler og transporterer en række last, såsom organeller, vesikler, proteiner og mRNA. Denne transport er afgørende for mange cellulære processer, herunder mitose, meiose og neuronal funktion. Kinesin-superfamilien er stor og forskelligartet med over 40 forskellige kinesin-gener identificeret i mennesker, hver kodende for proteiner med specialiserede funktioner og last-specifikke egenskaber.
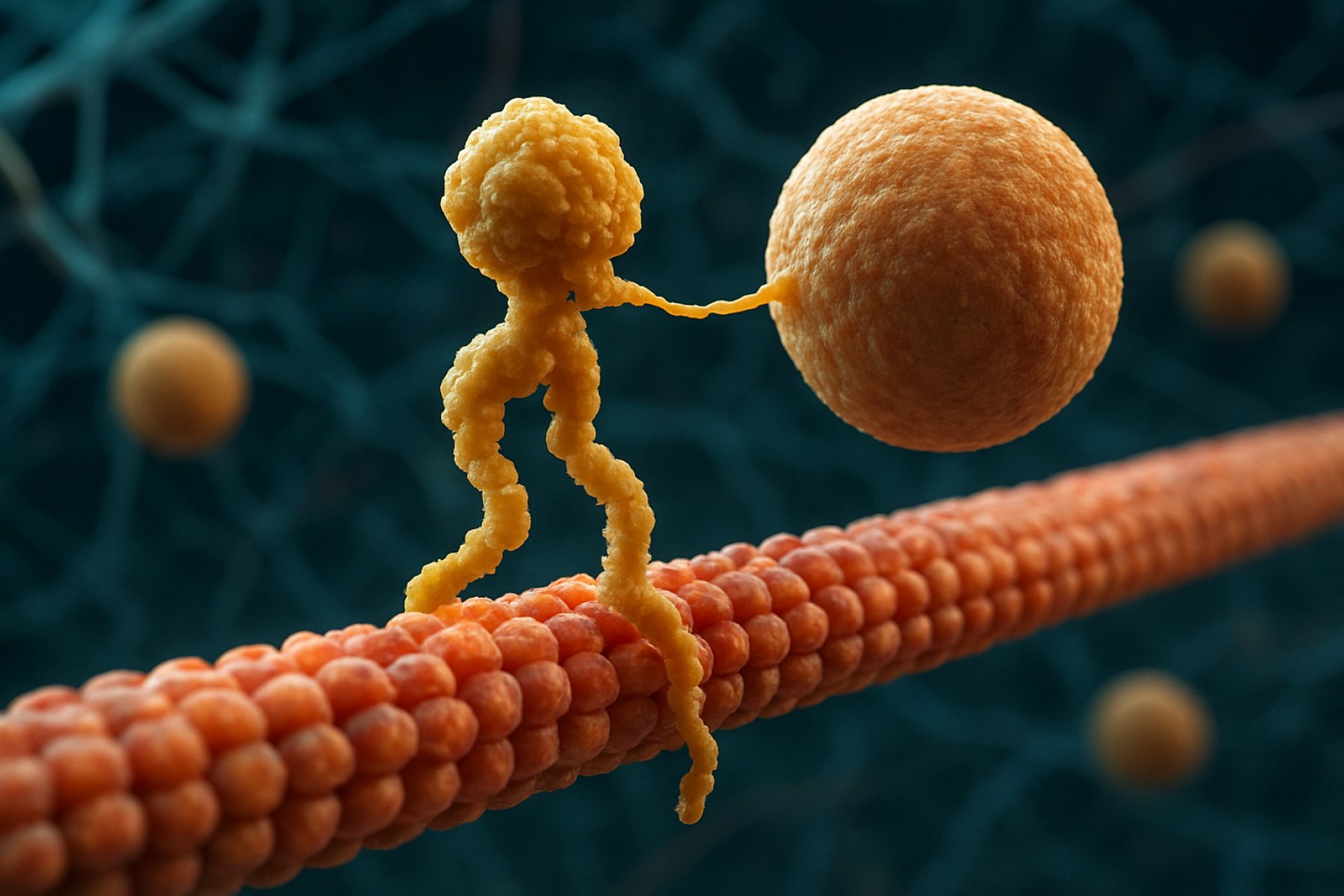
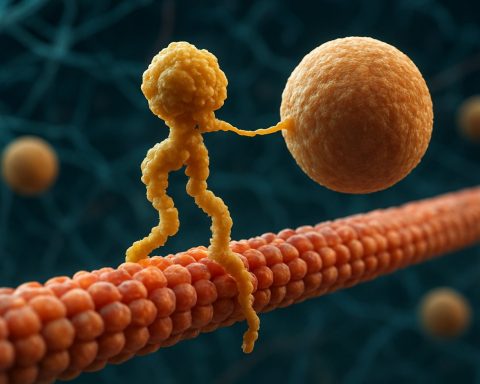
Strukturelt set består kinesiner typisk af to tunge kæder og to lette kæder. De tunge kæder indeholder et bevaret motorområde, der binder til mikrotubuli og hydrolyserer ATP for at generere bevægelse. Haledomaenerne af kinesinerne er ansvarlige for lastbinding, hvilket gør det muligt for motoren at transportere specifikke cellulære komponenter til deres tilsigtede destinationer. Kinesinens bevægelse er generelt rettet mod den positive ende af mikrotubuli, som typisk svarer til cellens perifer, selvom nogle kinesin-familie medlemmer bevæger sig mod den negative ende.
Mekanismen for kinesinens bevægelse beskrives ofte som en “hånd-over-hånd” gangbevægelse, hvor de to motorområder skiftevis binder og frigiver mikrotubuli, drevet af cyklusser med ATP-binding og hydrolyse. Denne procesive bevægelse gør det muligt for kinesiner at rejse lange afstande langs mikrotubuli uden at løsne sig, hvilket gør dem til meget effektive transportører i det tætbefolkede cellulære miljø. Den præcise regulering af kinesinens aktivitet er afgørende for at opretholde cellulær homeostase og funktion.
Kinesin motor proteiner er ikke kun essentielle for normale cellulære operationer, men de er også impliceret i forskellige sygdomme. Fejl i kinesinens funktion er blevet koblet til neurodegenerative lidelser, såsom Alzheimers sygdom og arvelig spastisk paraplegi, samt visse typer kræft. Som resultat er kinesiner genstand for intens forskning, både for at forstå deres grundlæggende biologi og for at udforske deres potentiale som terapeutiske mål.
Forskning om kinesin motor proteiner støttes og fremmes af førende videnskabelige organisationer og forskningsinstitutter verden over, herunder National Institutes of Health og Nature Publishing Group, som regelmæssigt publicerer fagfællebedømte studier om strukturen, funktionen og den biomedicinske betydning af disse proteiner. Den fortsatte undersøgelse af kinesiner afslører nye indsigter i de molekylære maskiner i livet og tilbyder lovende veje for udviklingen af nye medicinske interventioner.
Molekylær Struktur og Handlingsmekanisme
Kinesin motor proteiner er en superfamilie af ATP-afhængige molekylære motorer, der spiller en afgørende rolle i intracellulær transport, især langs mikrotubulebaner. Strukturelt set består kinesiner typisk af to tunge kæder og to lette kæder, der danner et heterotetramert kompleks. De tunge kæder indeholder et højt bevaret N-termalt motorområde (også kaldet “hovedet”), en snoet hals og et C-terminalt haledomain. Motorområdet er ansvarligt for binding til mikrotubuli og hydrolyse af ATP, hvilket giver den energi, der er nødvendig for bevægelse. Haledomaenet, derimod, er involveret i lastgenkendelse og binding, ofte ved at interagere med adaptorproteiner eller direkte med vesikler og organeller.
Handlingsmekanismen for kinesin motor proteiner beskrives ofte som en “hånd-over-hånd” gangbevægelse. Hver kinesin-molekyle har to motorområder, der skiftevis binder til og frigiver fra mikrotubuli, koordineret af ATP-binding og hydrolyse. Når en hoved binder til mikrotubuli og hydrolyserer ATP, gennemgår det en konformationsændring, der skyder den anden hoved fremad til det næste bindingssted, cirka 8 nanometer væk. Denne proces gentages, hvilket gør det muligt for kinesinen at “gå” i én retning langs mikrotubuli, typisk mod den positive ende, som er rettet mod cellens periferi. Den koordinerede handling af de to hoveder sikrer procesivitet, hvilket betyder, at kinesinen kan tage mange skridt langs en mikrotubuli uden at dissociere, hvilket er essentielt for effektiv lasttransport over lange afstande i cellen.
Kinesiner er meget forskellige, med over 40 forskellige kinesin-gener identificeret hos mennesker, hver tilpasset til specifikke cellulære funktioner. Mens de fleste kinesiner bevæger sig mod mikrotubuliens positive ende, bevæger nogle, såsom kinesin-14 familie medlemmer, sig mod den negative ende, hvilket fremhæver den funktionelle alsidighed i denne proteinfamilie. Aktiviteten og retningsbestemthed af kinesiner bestemmes af subtile forskelle i deres motorområder og tilknyttede reguleringsregioner.
Studiet af kinesinens struktur og funktion er blevet fremmet af højopløsnings teknikker som røntgenkrystallografi og cryo-elektronmikroskopi, som har afsløret detaljerede indsigter i de konformationsændringer, der ligger til grund for deres bevægelse. Disse fund har været afgørende for forståelsen af ikke kun grundlæggende cellebiologi, men også den molekylære basis for sygdomme relateret til kinesin dysfunktion, såsom visse neurodegenerative lidelser og kræft. Førende forskningsorganisationer, herunder National Institutes of Health og European Molecular Biology Laboratory, fortsætter med at undersøge de molekylære mekanismer for kinesin motor proteiner, hvilket understreger deres grundlæggende betydning i cellebiologi.
ATP Hydrolyse og Energikonversion
Kinesin motor proteiner er essentielle molekylære maskiner, der konverterer kemisk energi til mekanisk arbejde, hvilket muliggør transport af forskellige cellulære laster langs mikrotubuli. Den grundlæggende proces, der ligger til grund for denne bevægelse, er hydrolysen af adenosintrifosfat (ATP), som giver den energi, der kræves for kinesinens konformationsændringer og retningsbestemt bevægelse.
ATP-hydrolyse sker ved motorområderne (også kaldet “hovederne”) af kinesin-dimeren. Hvert hoved indeholder et højt konservativt nukleotidbindingssted, der skiftevis binder og hydrolyserer ATP. Det mekanokemiske cyklus begynder, når et kinesin-hoved, der er tæt bundet til mikrotubuli, binder ATP. Denne binding inducerer en konformationsændring i nakke-linkerområdet, der skubber det bagvedliggende hoved fremad i en “hånd-over-hånd” bevægelse. Når det førende hoved binder til den næste tubulin-enhed, hydrolyseres ATP til adenosindifosfat (ADP) og uorganisk fosfat (Pi), hvilket frigiver energi, der overføres til mekanisk bevægelse. Frigivelsen af Pi og efterfølgende udveksling af ADP til ATP nulstiller cyklussen, hvilket gør det muligt for kontinuerlig procesiv bevægelse langs mikrotubuli.
Effektiviteten af energikonversionen i kinesin er bemærkelsesværdig. Hver ATP-molekyle, der hydrolyseres, resulterer i et skridt på 8 nanometer langs mikrotubuli, med minimal energitab. Denne høje effektivitet tilskrives det tætte koblinger mellem ATP-hydrolyse og den mekaniske skridteknik. Processen er stærkt reguleret, hvilket sikrer, at ATP-hydrolyse kun sker, når kinesin-hovedet er korrekt engageret med mikrotubuli, hvilket forhindrer spild af energi.
Kinesinens ATPase-aktivitet er også påvirket af tilstedeværelsen af last og den specifikke type kinesin familiemedlem, der er involveret. For eksempel er konventionel kinesin-1 meget procesiv, i stand til at tage hundrede af skridt uden at dissociere fra mikrotubuli, mens andre kinesin-familie medlemmer kan have forskellige ATP-hydrolyse hastigheder og skridtmønstre, tilpasset deres cellulære funktioner.
Studiet af ATP-hydrolyse og energikonversion i kinesin har været afgørende for forståelsen af intracellulære transportmekanismer og bredere principper for molekylær motorfunktion. Forskning på dette område støttes af førende videnskabelige organisationer som National Institutes of Health og National Science Foundation, som finansierer undersøgelser af den strukturelle biologi og biofysik af motorproteiner. Indsigter opnået fra disse studier har implikationer for neurobiologi, celledeling og udviklingen af nanoteknologiske applikationer, der efterligner biologiske motorer.
Lastgenkendelse og Binding Specificitet
Kinesin motor proteiner er essentielle molekylære maskiner, der transporterer en bred vifte af intracellulære laster langs mikrotubulebaner, og spiller en central rolle i processer som organellepositionering, vesikeltransport og mitose. Den specifikation, hvormed kinesiner genkender og binder til deres last, er grundlæggende for nøjagtigheden og reguleringen af intracellulær transport. Denne specificitet opnås gennem en kombination af strukturelle egenskaber, adaptorproteiner og reguleringsmekanismer.
Kinesin-superfamilien er kendetegnet ved et bevaret motorområde, der er ansvarligt for ATP-hydrolyse og mikrotubulebinding, men funktionerne for lastgenkendelse og binding formidles primært af de variable haledomæner. Disse haleregioner varierer betydeligt blandt kinesin-familie medlemmer, hvilket muliggør selektiv interaktion med forskellige laster. For eksempel bruger kinesin-1 (også kendt som konventionel kinesin) sit C-terminale hale til at binde til forskellige laster, herunder membranbundne organeller og vesikler, ofte gennem adaptorproteiner som kinesin lette kæder (KLC’er). KLC’er indeholder tetratrikopeptidrepeterende (TPR) motiver, der faciliterer genkendelsen af specifikke last-associerede proteiner, hvilket dermed giver selektivitet til transportprocessen.
Adaptorproteiner spiller en afgørende rolle i at forbinde kinesiner til deres laster. Disse adaptorproteiner kan genkende specifikke signaler eller motiver på lastens overflade, hvilket sikrer, at kun den rette last transporteres af en given kinesin. For eksempel er interaktionen mellem KLC’er og JIP (c-Jun N-terminal kinase-interagerende protein) familie medlemmer veldokumenteret i neuronal transport, hvor JIPs fungerer som stænger, der forbinder kinesin-1 til vesikler, der indeholder signaleringsmolekyler. Andre kinesin familie medlemmer, såsom kinesin-3, bruger forskellige adaptorproteiner og haledomsstrukturer for at opnå last-specifik, hvilket afspejler mangfoldigheden af laster og cellulære kontekster, hvor kinesiner opererer.
Reguleringen af lastbinding opnås også gennem post-translationelle modificeringer og konkurrenceforhold. Phosphorylering af kinesin haler eller adaptorproteiner kan modulere bindende affinitet, hvilket muliggør dynamisk kontrol over lastens vedhæftning og frigivelse som reaktion på cellulære signaler. Derudover kan nogle laster konkurrere om binding til den samme kinesin, hvilket indfører et ekstra lag af regulering, der sikrer korrekt lasfordeling.
Studiet af lastgenkendelse og binding spesifik i kinesin motor proteiner er et hastigt udviklende felt med implikationer for forståelse af neurodegenerative sygdomme, intracellulære transportforstyrrelser og udviklingen af målrettede terapeutiske behandlinger. Førende forskningsorganisationer, såsom National Institutes of Health og European Molecular Biology Organization, støtter løbende undersøgelser af de molekylære mekanismer, der ligger til grund for kinesin-last interaktioner, og fremhæver den biomedicinske betydning af dette område.
Intracellulære Transportveje
Kinesin motor proteiner er essentielle molekylære maskiner, der driver intracellulær transport langs mikrotubulebaner, hvilket sikrer præcis levering af organeller, vesikler, proteiner og andre laster inden for eukaryote celler. Disse ATP-afhængige motorer er kendetegnet ved deres evne til at konvertere kemisk energi til mekanisk arbejde, hvilket letter bevægelsen af cellulære komponenter over lange afstande med bemærkelsesværdig retningsbestemthed og specificitet.
Strukturelt set består kinesiner typisk af to tunge kæder, der danner en dimer, hver med et globulært motorområde (hoved), der binder til mikrotubuli og hydrolyserer ATP. Haledomaenerne er ansvarlige for lastgenkendelse og binding, ofte i forbindelse med lette kæder eller adaptorproteiner. Det mest velundersøgte medlem, kinesin-1, bevæger sig primært mod den positive ende af mikrotubuli, som generelt svarer til cellens periferi, og spiller derfor en central rolle i anterograd transport.
Mekanismen for kinesin bevægelse beskrives ofte som en “hånd-over-hånd” gangbevægelse, hvor de to motorområder skiftevis binder og træder langs mikrotubuli-gitteret. Hvert skridt er tæt koblet til hydrolysen af et enkelt ATP-molekyle, hvilket sikrer procesivitet og retningsbestemthed. Denne koordinerede bevægelse gør det muligt for kinesiner at transportere laster over afstande, der kan strække sig over hele længden af en neuron eller andre store celletype.
Kinesiner klassificeres i flere familier baseret på sekvenshomologi og funktionel specialisering. Mens kinesin-1 primært er involveret i transport af organeller og vesikler, har andre familier såsom kinesin-2 og kinesin-3 forskellige roller i ciliær transport og synaptisk vesikeltrafik henholdsvis. Nogle kinesiner, såsom kinesin-5, er involveret i dynamik af mitotiske spidser snarere end lasttransport, hvilket fremhæver den funktionelle mangfoldighed inden for denne protein superfamilie.
Aktiviteten af kinesin motorer er nøje reguleret af cellulære signalveje, post-translationelle modificeringer og interaktioner med mikrotubuli-associerede proteiner. Denne regulering sikrer, at laster leveres til de korrekte subcellulære placeringer som reaktion på fysiologiske behov. Forstyrrelser i kinesin-medieret transport er blevet impliceret i forskellige sygdomme, herunder neurodegenerative lidelser, hvor defekt axonal transport bidrager til neuronal dysfunktion og degeneration.
Forskning i kinesin motor proteiner fortsætter med at fremme vores forståelse af cellulær logistik og har inspireret udviklingen af biomimetiske nanodevices. Førende videnskabelige organisationer som National Institutes of Health og Nature Publishing Group offentliggør regelmæssigt grundlæggende studier og anmeldelser af strukturen, funktionen og den biomedicinske betydning af kinesin motorer, hvilket understreger deres centrale rolle i cellebiologi.
Regulering af Kinesin Aktivitet
Kinesin motor proteiner er essentielle molekylære maskiner, der transporterer laster langs mikrotubuli inden for eukaryote celler. Reguleringen af kinesinens aktivitet er afgørende for at opretholde cellulær organisering, sikre korrekt distribution af organeller og støtte processer som mitose og neuronal funktion. Flere niveauer af regulering findes for at kontrollere hvornår, hvor og hvordan kinesiner interagerer med deres laster og mikrotubulebaner.
En primær reguleringsmekanisme er gennem autoinhibition. Mange kinesin familiemedlemmer, såsom kinesin-1, besidder haledomæner, der kan folde tilbage og interagere med deres motorområder, hvilket forhindrer ATPase-aktivitet og mikrotubulebinding i fravær af last. Denne autoinhiberede konformation lettes ved lastbinding, hvilket inducerer en konformationsændring, der aktiverer motoren til procesiv bevægelse. Denne mekanisme sikrer, at kinesiner kun er aktive når de er nødvendige, hvilket forhindrer unødig ATPforbrug og potentiel cellulær skade.
Post-translationelle modificeringer (PTM’er) spiller også en betydelig rolle i moduleringen af kinesinens aktivitet. Phosphorylering er den mest gennemgående studerede PTM, hvor kinaser som cyklin-afhængige kinaser (CDK’er) og glykogen syntase kinase 3 (GSK3) phosphorylerer specifikke rester på kinesin proteiner. Disse modifikationer kan enten forbedre eller hæmme motoraktiviteten afhængigt af konteksten og det specifikke kinesin involveret. For eksempel inhiberer phosphorylering af kinesin-1 af GSK3 dens evne til at binde til mikrotubuli, og dermed regulerer axonal transport i neuroner.
Cargo adaptor proteiner yder yderligere refinering af kinesinreguleringen. Disse adaptorproteiner, såsom JIP1 og Milton, forbinder kinesiner med specifikke laster og kan modulere motoraktiviteten ved at stabilisere den aktive konformation eller rekruttere yderligere regulatoriske faktorer. Samspillet mellem adaptorproteiner og motorer muliggør præcis rumlig og tidsmæssig kontrol af lastlevering, hvilket er især kritisk i højt polariserede celler såsom neuroner.
Derudover kan selve mikrotubuli-baner påvirke kinesinaktiviteten. Mikrotubuli-associerede proteiner (MAP’er) og tubulin post-translationelle modifikationer (såsom acetylering eller detyrosinering) kan ændre bindeaffiniteten og motiliteten af kinesiner, effektivt guide eller begrænse deres bevægelse langs specifikke mikrotubuliundersæt.
Reguleringen af kinesin motor proteiner er et emne for igangværende forskning, med implikationer for forståelsen af neurodegenerative sygdomme, kræft og udviklingsforstyrrelser. Førende organisationer som National Institutes of Health og Nature Publishing Group støtter og formidler forskning inden for dette felt, hvilket fremhæver vigtigheden af kinesinregulering i sundhed og sygdom.
Kinesin i Neuronal Funktion og Axonal Transport
Kinesin motor proteiner er en superfamilie af ATP-afhængige molekylære motorer, der spiller en afgørende rolle i intracellulær transport, især inden for det højt polariserede miljø i neuroner. Disse proteiner bevæger sig langs mikrotubulebaner, der konverterer kemisk energi fra ATP-hydrolyse til mekanisk arbejde, hvilket muliggør den rettede bevægelse af forskellige cellulære laster. I neuroner er kinesiner essentielle for transport af organeller, synaptiske vesikelprecursorer, proteiner og mRNA fra cellekroppen (soma) til axonterminalen, en proces kendt som anterograd axonal transport.
Kinesin superfamilien er forskelligartet, med over 40 forskellige kinesin-gener identificeret hos mennesker, hver kodende for proteiner med specialiserede funktioner og last-specifikke egenskaber. Det mest velkarakteriserede medlem, kinesin-1 (også kendt som konventionel kinesin), er en heterotetramer bestående af to tunge kæder og to lette kæder. De tunge kæder indeholder motorområderne, der er ansvarlige for ATP-hydrolyse og mikrotubulebinding, mens de lette kæder formidler lastgenkendelse og binding. Denne strukturelle organisering gør det muligt for kinesin-1 at transportere en bred vifte af laster, der er kritiske for neuronal funktion og overlevelse.
Axonal transport er vital for at opretholde neuronal sundhed og funktion, givet længden på nogle axoner, som kan strække sig op til en meter hos mennesker. Kinesindrevet anterograd transport sikrer den rettidige levering af synaptiske komponenter, mitokondrier og andre essentielle organeller til de distale områder af neuronen. Forstyrrelse af kinesinens funktion kan føre til mangler i synaptisk transmission, axonal degeneration, og er blevet impliceret i flere neurodegenerative sygdomme, herunder Alzheimers sygdom og amyotrofisk lateral sklerose (ALS). Vigtigheden af kinesin-medieret transport i neuronal sundhed understreges af forskning fra førende videnskabelige organisationer som National Institutes of Health og National Institute of Neurological Disorders and Stroke, som har fremhævet forbindelsen mellem axonal transport fejl og neurodegeneration.
Ud over anterograd transport koordinerer kinesiner også med dynein motorproteiner, som medierer retrograd transport (fra axon-terminalen tilbage til soma), for at opretholde den bidirektionale strøm af materialer, der er nødvendig for neuronal homeostase. Den præcise regulering af kinesinaktivitet, lastudvælgelse og koordinering med andre motorproteiner er et emne for igangværende forskning, med implikationer for at forstå den molekylære basis for neuronal forbindelse, plasticitet og sygdom.
Sammenlignende Analyse: Kinesin vs. Dynein og Myosin
Kinesin motor proteiner er en grundlæggende klasse af molekylære motorer, der spiller en kritisk rolle i intracellulær transport, især langs mikrotubulebaner. For fuldt ud at værdsætte deres biologiske betydning er det essentielt at sammenligne kinesiner med de to andre store familier af cytoskeletale motorproteiner: dyneiner og myosiner. Hver af disse motorproteiner er specialiseret til bevægelse langs forskellige cytoskeletale filamenter og tilpasset til specifikke cellulære funktioner.
Kinesiner og dyneiner krydser begge mikrotubuli, men de adskiller sig i deres retningsbestemthed og lastspecifikation. Kinesiner bevæger sig generelt mod den positive ende af mikrotubuli, som typisk er rettet mod cellens periferi, hvilket letter den anterograde transport af organeller, vesikler og protein-komplekser. I modsætning hertil bevæger dyneiner sig mod den negative ende af mikrotubuli og dirigerer laster mod cellens centrum, såsom kernen eller mikrotubuli organiserende center. Dette bidirektionale system sikrer effektiv distribution og genbrug af cellulære komponenter. Strukturelt set er kinesiner typisk homodimeriske eller heterodimeriske proteiner med to motorområder, mens cytoplasmatiske dyneiner er store, multi-subunit komplekser med en mere kompleks mekanisme af kraftgenerering og regulering (National Institute of Genetics).
Myosiner, derimod, er primært aktin-baserede motorproteiner. De er bedst kendt for deres rolle i muskelkontraktion, men de deltager også i en række ikke-muskel cellulære processer, såsom cytokinese, vesikeltransport og cellemotilitet. I modsætning til kinesiner og dyneiner, der bevæger sig langs mikrotubuli, krydser myosiner aktinfilamenter, normalt mod den positive (barbed) ende. Den strukturelle organisering af myosiner er distinkt, med et karakteristisk hovedområde, der binder aktin og hydrolyserer ATP, en nakke-region og en hale, der bestemmer lastspecifik.
Funktionelt er de tre motorproteinfamilier tilpasset deres respektive cytoskeletale spor og cellulære roller. Kinesiner er afgørende for langdistance, retningsbestemt transport i neuroner og delende celler, mens dyneiner er essentielle for retrograd transport og ciliær/flagellar bevægelse. Myosiner er derimod centrale i processer, der kræver kraftgenerering og kortdistance transport på aktinnetværk. Samspillet mellem disse motorer sikrer den dynamiske organisering og tilpasningsevne af den eukaryote celle.
Sammenfattende, mens kinesiner, dyneiner og myosiner deler den grundlæggende egenskab at konvertere kemisk energi fra ATP-hydrolyse til mekanisk arbejde, er de specialiseret til forskellige spor, retninger og cellulære funktioner. Deres koordinerede handlinger er vitale for at opretholde cellulær arkitektur, signalering og homeostase.
Kinesin-Relaterede Sygdomme og Terapeutiske Mål
Kinesin motor proteiner er essentielle molekylære maskiner, der transporterer forskellige cellulære laster langs mikrotubuli, og spiller en central rolle i intracellulær trafik, mitose og neuronal funktion. Dysregulering eller mutation af kinesin-gener har været impliceret i en række menneskelige sygdomme, hvilket gør disse proteiner væsentlige både som biomarkører og som potentielle terapeutiske mål.
En af de mest veldokumenterede sygdomsforbindelser involverer kinesinfamilie medlemmet KIF1A. Mutationer i KIF1A genet er knyttet til et spektrum af neurodegenerative lidelser, samlet kaldet KIF1A-associeret neurologisk sygdom (KAND). Disse tilstande viser sig som intellektuel handicap, spastisk paraplegi og progressiv neurodegeneration. Den underliggende patologi tilskrives ofte nedsat axonal transport, som forstyrrer synaptisk funktion og neuronal overlevelse. Tilsvarende er mutationer i andre kinesin-gener, såsom KIF5A og KIF21A, forbundet med arvelig spastisk paraplegi og medfødt fibrose af de ekstraokulære muskler, hvilket yderligere understreger den kritiske rolle kinesiner spiller i nervesystemets sundhed.
Udover neurodegeneration er kinesin motor proteiner også impliceret i kræft. For eksempel er KIF11 (også kendt som Eg5) essentiel for mitotiske spidse dannelse under celledeling. Overudtryk eller hyperaktivitet af KIF11 er blevet observeret i forskellige kræftformer, herunder bryst- og prostatakræft, hvor det bidrager til ukontrolleret celleproliferation. Som et resultat er KIF11 blevet et lovende mål for anti-mitotiske kræftterapier. Flere småmolekylære inhibitorer af KIF11, såsom ispinesib, er kommet ind i kliniske forsøg med det mål at selektivt forstyrre kræftcelledeling samtidig med at normale celler undgås. Udviklingen og evalueringen af disse inhibitorer overvåges nøje af regulerende og forskningsorganisationer som National Cancer Institute og U.S. Food and Drug Administration.
Terapeutiske strategier, der retter sig mod kinesin motor proteiner, strækker sig ud over onkologi. I neurodegenerative sygdomme er der igangværende bestræbelser på at udvikle molekyler, der kan genoprette eller modulere kinesinens funktion, hvilket potentielt kan forbedre defekter i axonal transport. Derudover udforsker forskning støttet af organisationer som National Institutes of Health genterapi og småmolekylære tilgange for at korrigere eller kompensere for defekt kinesinaktivitet i genetiske lidelser.
Sammenfattende er kinesin motor proteiner centrale for cellulær sundhed, og deres dysfunktion er knyttet til en række sygdomme, især i nervesystemet og i kræft. Løbende forskning og kliniske udviklingsindsatser fortsætter med at udforske kinesiner som både biomarkører og terapeutiske mål, med potentiale for at give nye behandlinger for i øjeblikket uhelbredelige tilstande.
Ny Forskning og Fremtidige Retninger
Ny forskning om kinesin motor proteiner udvider hurtigt vores forståelse af deres roller i cellulære processer og deres potentielle anvendelser inden for bioteknologi og medicin. Kinesiner er en superfamilie af ATP-afhængige molekylære motorer, der transporterer laster langs mikrotubuli, og spiller essentielle roller i intracellulær trafik, mitose og neuronal funktion. Nyeste fremskridt inden for højopløsningsbilleddannelse og enkeltmolekylær biofysik har gjort det muligt for forskere at visualisere kinesin-dynamik i hidtil uset detalje, hvilket afslører nye indsigter i deres mekanokemiske cykler og reguleringsmekanismer.
En lovende retning involverer opklaring af kinesinens strukturelle mangfoldighed og dens implikationer for lastspecifik og regulering. Strukturel biologi teknikker, såsom cryo-elektronmikroskopi, har afdækket distinkte konformationsstater af kinesin familier, hvilket tyder på specialiserede tilpasninger til forskellige cellulære opgaver. Denne strukturelle viden informerer designet af små molekyler og peptider, der kan modulere kinesinens aktivitet, med potentielle terapeutiske anvendelser i neurodegenerative sygdomme og kræft, hvor aberrant kinesin funktion er impliceret i patogenese.
Syntetisk biologi udnytter også kinesinmotorer til at konstruere nanoscale transportsystemer. Ved at udnytte den retningsbestemte bevægelse af kinesiner udvikler forskere biomimetiske enheder til målrettet lægemiddeltransport og molekylær samling. Disse innovationer kan revolutionere præcisionsmedicin ved at muliggøre den kontrollerede transport af terapeutiske midler inden for celler eller væv.
Et andet nyt område er studiet af kinesinens rolle i neuronal sundhed og sygdom. Mutationer i kinesin-gener er blevet knyttet til arvelig spastisk paraplegi, Charcot-Marie-Tooth sygdom og andre neurodegenerative lidelser. Løbende forskning har til formål at afdække, hvordan disse mutationer forstyrrer axonal transport og at identificere strategier for at genskabe normal funktion. National Institutes of Health og National Institute of Neurological Disorders and Stroke støtter initiativer for at undersøge de molekylære grundlag for disse sygdomme og for at udvikle målrettede interventioner.
Ser man fremad, forventes integrationen af beregningsmodeller, avanceret mikroskopi og genredigeringsteknologier at fremskynde opdagelser inden for kinesinbiologi. Samarbejdende bestræbelser blandt akademiske institutioner, regeringsagenturer og bioteknologiske selskaber fremmer oversættelsen af grundforskning til kliniske og industrielle anvendelser. Efterhånden som vores forståelse af kinesin motor proteiner bliver dybere, vil der opstå nye muligheder for at manipulere intracellulær transport, diagnosticere sygdomme og designe innovative terapeutiske strategier.
Kilder & Referencer
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute