Kinesin-Motorproteine: Die dynamischen Motoren, die die intrazelluläre Logistik antreiben. Entdecken Sie, wie diese molekularen Maschinen die Zellfunktion und Gesundheit revolutionieren.
- Einführung in Kinesin-Motorproteine
- Molekulare Struktur und Wirkmechanismus
- ATP-Hydrolyse und Energieumwandlung
- Cargo-Erkennung und Bindungsspezifität
- Intrazelluläre Transportwege
- Regulation der Kinesin-Aktivität
- Kinesin in der neuronalen Funktion und axonalem Transport
- Vergleichsanalyse: Kinesin vs. Dynein und Myosin
- Kinesin-assoziierte Krankheiten und therapeutische Ziele
- Aufkommende Forschung und zukünftige Richtungen
- Quellen & Referenzen
Einführung in Kinesin-Motorproteine
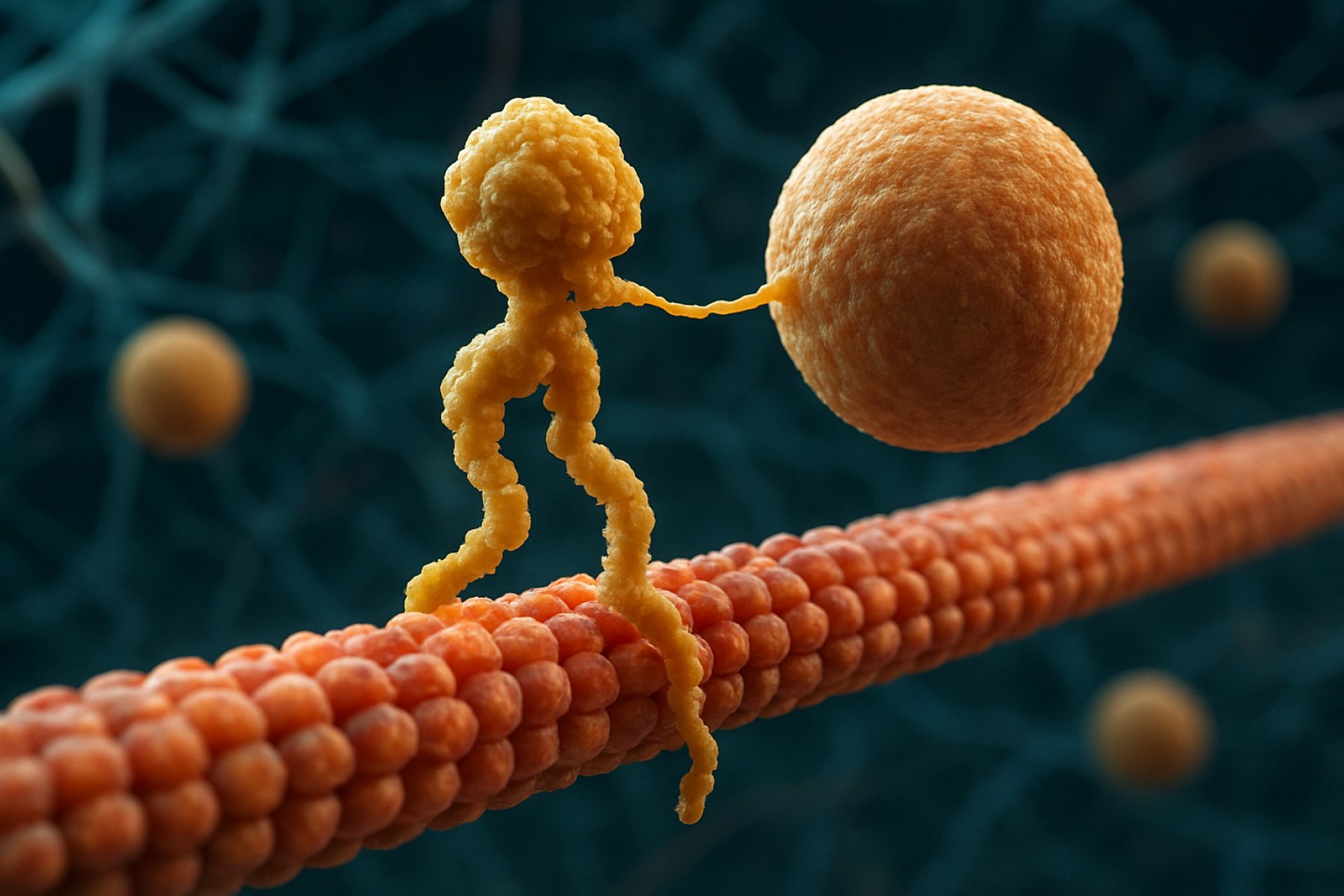
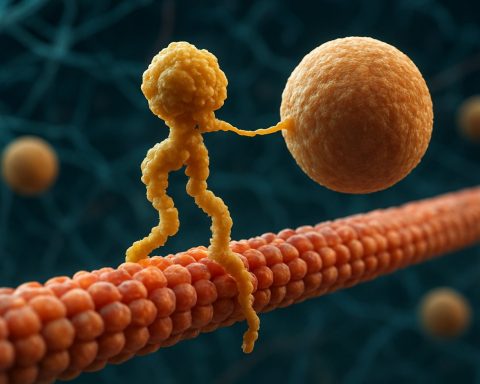
Kinesin-Motorproteine sind eine fundamentale Klasse von molekularen Motoren, die eine entscheidende Rolle im intrazellulären Transport und in der zellulären Organisation spielen. Sie wurden Mitte der 1980er Jahre entdeckt und sind ATP-abhängige Proteine, die entlang von Mikrotubuli in eukaryotischen Zellen bewegen und eine Vielzahl von Cargos wie Organellen, Vesikel, Proteine und mRNA transportieren. Dieser Transport ist essenziell für zahlreiche Zellprozesse, einschließlich Mitose, Meiose und neuronale Funktion. Die Kinesin-Superfamilie ist groß und vielfältig, mit über 40 verschiedenen Kinesin-Genen, die beim Menschen identifiziert wurden, von denen jedes Proteine mit spezialisierten Funktionen und Cargo-Spezifitäten kodiert.
Strukturell bestehen Kinesine typischerweise aus zwei schweren Ketten und zwei leichten Ketten. Die schweren Ketten enthalten eine konservierte Motor-Domäne, die an Mikrotubuli bindet und ATP hydrolysiert, um Bewegung zu erzeugen. Die Schwanzdomänen der Kinesine sind für die Cargo-Bindung verantwortlich, sodass der Motor spezifische zelluläre Komponenten zu ihren vorgesehenen Zielen transportieren kann. Die Bewegung von Kinesin ist in der Regel auf das Plus-Ende der Mikrotubuli gerichtet, das normalerweise der Zellperipherie entspricht, obwohl einige Mitglieder der Kinesin-Familie in Richtung des Minus-Endes bewegen.
Der Mechanismus der Kinesin-Bewegung wird oft als „Hand-über-Hand“-Gangbewegung beschrieben, bei der die beiden Motordomänen abwechselnd an das Mikrotubulus binden und es wieder loslassen, was durch Zyklen der ATP-Bindung und -Hydrolyse angetrieben wird. Diese prozessive Bewegung ermöglicht es Kinesinen, weite Strecken entlang von Mikrotubuli zurückzulegen, ohne sich zu lösen, was sie zu hoch effizienten Transportern in der überfüllten zellulären Umgebung macht. Die präzise Regulation der Kinesin-Aktivität ist entscheidend, um die zelluläre Homöostase und Funktion aufrechtzuerhalten.
Kinesin-Motorproteine sind nicht nur für normale Zellvorgänge vital, sondern auch an verschiedenen Krankheiten beteiligt. Defekte in der Kinesin-Funktion wurden mit neurodegenerativen Erkrankungen wie Alzheimer und vererblicher spastischer Paraplegie sowie bestimmten Krebsarten in Verbindung gebracht. Infolgedessen sind Kinesine Gegenstand intensiver Forschung, um sowohl ihre grundlegende Biologie zu verstehen als auch ihr Potenzial als therapeutische Ziele zu erkunden.
Die Forschung zu Kinesin-Motorproteinen wird von führenden wissenschaftlichen Organisationen und Forschungsinstituten weltweit unterstützt und vorangetrieben, darunter die National Institutes of Health und die Nature Publishing Group, die regelmäßig peer-reviewed Studien zur Struktur, Funktion und biomedizinischen Bedeutung dieser Proteine veröffentlichen. Die fortlaufende Studie von Kinesinen offenbart weiterhin neue Einblicke in die molekulare Maschinerie des Lebens und bietet vielversprechende Wege für die Entwicklung neuartiger medizinischer Interventionen.
Molekulare Struktur und Wirkmechanismus
Kinesin-Motorproteine sind eine Superfamilie von ATP-abhängigen molekularen Motoren, die eine entscheidende Rolle im intrazellulären Transport, insbesondere entlang von Mikrotubuli, spielen. Strukturell bestehen Kinesine typischerweise aus zwei schweren Ketten und zwei leichten Ketten, die einen heterotetrameren Komplex bilden. Die schweren Ketten enthalten eine stark konservierte N-terminal Motor-Domäne (auch als „Kopf“ bezeichnet), einen coil-coil Stiel und eine C-terminale Schwanzdomäne. Die Motordomäne ist verantwortlich für die Bindung an Mikrotubuli und die Hydrolyse von ATP, die die Energie liefert, die für die Bewegung erforderlich ist. Die Schwanzdomäne hingegen ist an der Cargo-Erkennung und -Bindung beteiligt und interagiert häufig mit Adapterproteinen oder direkt mit Vesikeln und Organellen.
Der Wirkmechanismus der Kinesin-Motorproteine wird oft als „Hand-über-Hand“-Gangbewegung beschrieben. Jedes Kinesin-Molekül hat zwei Motordomänen, die abwechselnd an das Mikrotubulus binden und sich davon lösen, koordiniert durch die Bindung und Hydrolyse von ATP. Wenn ein Kopf an das Mikrotubulus bindet und ATP hydrolysiert, erfährt er eine Konformationsänderung, die den anderen Kopf vorwärts zum nächsten Bindungsort bewegt, der etwa 8 Nanometer entfernt ist. Dieser Prozess wiederholt sich, sodass das Kinesin „unidirektional“ entlang des Mikrotubulus gehen kann, typischerweise in Richtung des Plus-Endes, das in Richtung der Zellperipherie orientiert ist. Die koordinierte Aktion der beiden Köpfe gewährleistet die Prozessivität, was bedeutet, dass das Kinesin viele Schritte entlang eines Mikrotubulus machen kann, ohne sich zu dissoziieren, was für einen effizienten Cargo-Transport über lange Strecken innerhalb der Zelle entscheidend ist.
Kinesine sind sehr vielfältig, mit über 40 verschiedenen Kinesin-Genen, die beim Menschen identifiziert wurden, von denen jedes für spezifische Zellfunktionen adaptiert ist. Während die meisten Kinesine in Richtung des Plus-Endes von Mikrotubuli bewegen, bewegen sich einige, wie beispielsweise Mitglieder der Kinesin-14-Familie, in Richtung des Minus-Endes, was die funktionelle Vielseitigkeit dieser Proteinfamilie unterstreicht. Die Aktivität und Richtung von Kinesinen werden durch subtile Unterschiede in ihren Motordomänen und den zugehörigen regulatorischen Regionen bestimmt.
Die Untersuchung von Struktur und Funktion von Kinesin wurde durch hochauflösende Techniken wie die Röntgenkristallographie und die Kryo-Elektronenmikroskopie vorangetrieben, die detaillierte Einblicke in die Konformationsänderungen, die ihrer Beweglichkeit zugrunde liegen, offenbart haben. Diese Erkenntnisse waren entscheidend, um nicht nur die grundlegende Zellbiologie zu verstehen, sondern auch die molekulare Basis von Krankheiten zu erfassen, die mit der Dysfunktion von Kinesin in Verbindung stehen, wie bestimmten neurodegenerativen Erkrankungen und Krebsarten. Führende Forschungsorganisationen, darunter die National Institutes of Health und das European Molecular Biology Laboratory, untersuchen weiterhin die molekularen Mechanismen der Kinesin-Motorproteine und betonen deren fundamentale Bedeutung in der Zellbiologie.
ATP-Hydrolyse und Energieumwandlung
Kinesin-Motorproteine sind essentielle molekulare Maschinen, die chemische Energie in mechanische Arbeit umwandeln und so den Transport verschiedener zellulärer Cargoe entlang von Mikrotubuli ermöglichen. Der fundamentale Prozess, der dieser Bewegung zugrunde liegt, ist die Hydrolyse von Adenosintriphosphat (ATP), die die Energie bereitstellt, die für Kinesins Konformationsänderungen und gerichtete Mobilität erforderlich ist.
Die ATP-Hydrolyse erfolgt an den Motordomänen (auch als „Köpfe“ bezeichnet) des Kinesin-Dimers. Jeder Kopf enthält eine stark konservierte Nukleotid-Bindungsstelle, die abwechselnd ATP bindet und hydrolysiert. Der mechanochemische Zyklus beginnt, wenn ein Kinesin-Kopf, der fest an das Mikrotubulus gebunden ist, ATP bindet. Diese Bindung löst eine Konformationsänderung im Nackenbindungsbereich aus, die den nachfolgenden Kopf in einer „Hand-über-Hand“-Bewegung vorwärts befördert. Wenn der führende Kopf an die nächste Tubulin-Untereinheit bindet, wird ATP zu Adenosindiphosphat (ADP) und anorganischem Phosphat (Pi) hydrolysiert, wodurch Energie freigesetzt wird, die in mechanische Bewegung umgewandelt wird. Die Freisetzung von Pi und der anschließende Austausch von ADP gegen ATP setzen den Zyklus zurück, sodass eine kontinuierliche prozessive Bewegung entlang des Mikrotubulus möglich ist.
Die Effizienz der Energieumwandlung in Kinesin ist bemerkenswert. Jede hydrolysierte ATP-Molekül führt zu einem 8-Nanometer-Schritt entlang des Mikrotubulus, mit minimalem Energieverlust. Diese hohe Effizienz ist dem engen Zusammenhang zwischen ATP-Hydrolyse und dem mechanischen Schrittmechanismus zu verdanken. Der Prozess ist stark reguliert, um sicherzustellen, dass die ATP-Hydrolyse nur dann erfolgt, wenn der Kinesin-Kopf korrekt mit dem Mikrotubulus verbunden ist, was eine verschwenderische Energieausgabe verhindert.
Die ATPase-Aktivität von Kinesin wird auch durch das Vorhandensein von Cargo und den spezifischen Typ des beteiligten Kinesinfamilienmitglieds moduliert. Beispielsweise ist das konventionelle Kinesin-1 hoch prozessiv und in der Lage, Hunderte von Schritten ohne Dissoziation vom Mikrotubulus zu machen, während andere Mitglieder der Kinesin-Familie unterschiedliche ATP-Hydrolyseraten und Schrittverhalten aufweisen, die auf ihre zellulären Funktionen abgestimmt sind.
Die Untersuchung von ATP-Hydrolyse und Energieumwandlung in Kinesin war entscheidend, um die intrazellulären Transportmechanismen und die breiteren Prinzipien der Funktion molekularer Motoren zu verstehen. Die Forschung auf diesem Gebiet wird von führenden wissenschaftlichen Organisationen wie den National Institutes of Health und der National Science Foundation unterstützt, die Forschungen zur strukturellen Biologie und Biophysik von Motorproteinen finanzieren. Die Erkenntnisse aus diesen Studien haben Auswirkungen auf die Neurobiologie, Zellteilung und die Entwicklung nanotechnologischer Anwendungen, die biologische Motoren nachahmen.
Cargo-Erkennung und Bindungsspezifität
Kinesin-Motorproteine sind essentielle molekulare Maschinen, die eine Vielzahl intrazellulärer Cargos entlang von Mikrotubuli transportieren und eine zentrale Rolle bei Prozessen wie der Positionierung von Organellen, dem Vesikelverkehr und der Mitose spielen. Die Spezifität, mit der Kinesine ihre Cargos erkennen und binden, ist grundlegend für die Genauigkeit und Regulation des intrazellulären Transports. Diese Spezifität wird durch eine Kombination struktureller Merkmale, Adapterproteine und regulatorische Mechanismen erreicht.
Die Kinesin-Superfamilie ist durch eine konservierte Motordomäne gekennzeichnet, die für die ATP-Hydrolyse und die Bindung an Mikrotubuli verantwortlich ist, während die Funktionen zur Cargo-Erkennung und -Bindung hauptsächlich durch die variablen Schwanzdomänen vermittelt werden. Diese Schwanzregionen unterscheiden sich signifikant zwischen den Mitgliedern der Kinesin-Familie, was eine selektive Interaktion mit unterschiedlichen Cargos ermöglicht. Beispielsweise verwendet Kinesin-1 (auch bekannt als konventionelles Kinesin) seine C-terminale Schwanzdomäne, um an eine Vielzahl von Cargos zu binden, einschließlich membrangebundenen Organellen und Vesikeln, oft über Adapterproteine wie Kinesin-Leichtketten (KLCs). KLCs enthalten Tetratrikopeptid-Wiederholungsmotive (TPR), die die Erkennung spezifischer cargo-assoziierter Proteine erleichtern und somit Selektivität im Transportprozess verleihen.
Adapterproteine spielen eine entscheidende Rolle, indem sie Kinesine mit ihren Cargos verbinden. Diese Adapter können spezifische Signale oder Motive auf der Cargo-Oberfläche erkennen und sicherstellen, dass nur das geeignete Cargo von einem bestimmten Kinesin transportiert wird. Beispielsweise ist die Interaktion zwischen KLCs und JIP (c-Jun N-terminal kinase-interacting protein) Familienmitgliedern gut dokumentiert im neuronalen Transport, wo JIPs als Gerüste fungieren, die Kinesin-1 mit Vesikeln verbinden, die Signalmoleküle enthalten. Andere Mitglieder der Kinesin-Familie, wie Kinesin-3, verwenden unterschiedliche Adapter und Strukturen der Schwanzdomäne, um die Cargo-Spezifität zu erreichen, was die Vielfalt der Cargos und zellulären Kontexte widerspiegelt, in denen Kinesine operieren.
Die Regulation der Cargo-Bindung erfolgt ebenfalls durch posttranslationalen Modifikationen und konkurrierende Interaktionen. Die Phosphorylierung von Kinesin-Schwänzen oder Adapterproteinen kann die Bindungsaffinität modulieren und eine dynamische Kontrolle über die Cargo-Anhaftung und -Freisetzung in Reaktion auf zelluläre Signale ermöglichen. Darüber hinaus können einige Cargos um die Bindung an dasselbe Kinesin konkurrieren, was eine weitere Regulierungsebene einführt und so die ordnungsgemäße Cargo-Verteilung sicherstellt.
Die Untersuchung von Cargo-Erkennung und Bindungsspezifität in Kinesin-Motorproteinen ist ein sich schnell entwickelndes Feld, mit Auswirkungen auf das Verständnis neurodegenerativer Krankheiten, Störungen des intrazellulären Verkehrs und die Entwicklung gezielter Therapeutika. Führende Forschungsorganisationen wie die National Institutes of Health und die European Molecular Biology Organization unterstützen laufende Untersuchungen der molekularen Mechanismen, die den Kinesin-Cargo-Interaktionen zugrunde liegen, und heben die biomedizinische Bedeutung dieses Bereichs hervor.
Intrazelluläre Transportwege
Kinesin-Motorproteine sind essentielle molekulare Maschinen, die den intrazellulären Transport entlang von Mikrotubuli antreiben und die präzise Lieferung von Organellen, Vesikeln, Proteinen und anderen Cargos innerhalb eukaryotischer Zellen sicherstellen. Diese ATP-abhängigen Motoren sind charakterisiert durch ihre Fähigkeit, chemische Energie in mechanische Arbeit umzuwandeln, und ermöglichen die Bewegung zellulärer Komponenten über lange Strecken mit bemerkenswerter Richtung und Spezifität.
Strukturell bestehen Kinesine typischerweise aus zwei schweren Ketten, die ein Dimer bilden, wobei jede eine globuläre Motordomäne (Kopf) hat, die an Mikrotubuli bindet und ATP hydrolysiert. Die Schwanzdomänen sind für die Cargo-Erkennung und -Bindung verantwortlich, oft in Verbindung mit leichten Ketten oder Adapterproteinen. Das am besten untersuchte Mitglied, Kinesin-1, bewegt sich hauptsächlich in Richtung des Plus-Endes der Mikrotubuli, welches normalerweise der Zellperipherie entspricht, und spielt somit eine zentrale Rolle im anterograden Transport.
Der Mechanismus der Kinesin-Bewegung wird oft als „Hand-über-Hand“-Gangbewegung beschrieben, bei der die beiden Motordomänen abwechselnd binden und sich entlang des Mikrotubulus-Rasters fortbewegen. Jeder Schritt ist eng gekoppelt an die Hydrolyse eines einzelnen ATP-Moleküls, wodurch die Prozessivität und Richtunglichkeit sichergestellt wird. Diese koordinierte Bewegung ermöglicht es Kinesinen, Cargos über Strecken zu transportieren, die die gesamte Länge eines Neurons oder anderer großer Zelltypen umfassen können.
Kinesine werden in mehrere Familien eingeteilt, basierend auf Sequenzhomologie und funktionaler Spezialisierung. Während Kinesin-1 hauptsächlich am Transport von Organellen und Vesikeln beteiligt ist, haben andere Familien, wie Kinesin-2 und Kinesin-3, unterschiedliche Rollen im ciliären Transport und im Transport synaptischer Vesikel. Einige Kinesine, wie Kinesin-5, sind an der Dynamik des mitotischen Spindels beteiligt, anstatt am Cargo-Transport, was die funktionale Vielfalt innerhalb dieser Protein-Superfamilie unterstreicht.
Die Aktivität der Kinesin-Motoren wird eng durch zelluläre Signalwege, posttranslationalen Modifikationen und Interaktionen mit mikrotubuli-assoziierten Proteinen reguliert. Diese Regulierung stellt sicher, dass Cargos an die richtigen subzellulären Orte in Reaktion auf physiologische Bedürfnisse geliefert werden. Eine Störung des Kinesin-vermittelten Transports wurde mit verschiedenen Erkrankungen in Verbindung gebracht, einschließlich neurodegenerativer Störungen, bei denen defekter axonaler Transport zur neuronalen Dysfunktion und Degeneration beiträgt.
Die Forschung zu Kinesin-Motorproteinen trägt weiterhin zu unserem Verständnis der zellulären Logistik bei und hat die Entwicklung biomimetischer Nanovorrichtungen inspiriert. Führende wissenschaftliche Organisationen wie die National Institutes of Health und die Nature Publishing Group veröffentlichen regelmäßig grundlegende Studien und Übersichten über die Struktur, Funktion und biomedizinische Bedeutung von Kinesin-Motoren und betonen deren zentrale Rolle in der Zellbiologie.
Regulation der Kinesin-Aktivität
Kinesin-Motorproteine sind essentielle molekulare Maschinen, die Cargo entlang von Mikrotubuli innerhalb eukaryotischer Zellen transportieren. Die Regulation der Kinesin-Aktivität ist entscheidend, um die zelluläre Organisation aufrechtzuerhalten, die ordnungsgemäße Verteilung von Organellen zu gewährleisten und Prozesse wie Mitose und neuronale Funktionen zu unterstützen. Es gibt mehrere Regulationsebenen, um zu steuern, wann, wo und wie Kinesine mit ihrem Cargo und Mikrotubuli interagieren.
Ein primärer Regulationsmechanismus ist die Autoinhibition. Viele Mitglieder der Kinesin-Familie, wie Kinesin-1, besitzen Schwanzdomänen, die zurückfalten und mit ihren Motordomänen interagieren können, was die ATPase-Aktivität und die Bindung an Mikrotubuli in Abwesenheit von Cargo verhindert. Diese autoinhibierte Konformation wird nach der Cargo-Bindung gelockert, was eine Konformationsänderung induziert, die den Motor für prozessive Bewegung aktiviert. Dieser Mechanismus stellt sicher, dass Kinesine nur aktiv sind, wenn sie benötigt werden, was eine unnötige ATP-Verbrauch und potenzielle Zellschäden verhindert.
Posttranslationalen Modifikationen (PTMs) spielen ebenfalls eine wesentliche Rolle bei der Modulation der Kinesin-Aktivität. Die Phosphorylierung ist die meist untersuchte PTM, wobei Kinasen wie cyclinabhängige Kinasen (CDKs) und Glykogen-Synthase-Kinase 3 (GSK3) spezifische Reste an Kinesin-Proteinen phosphorylieren. Diese Modifikationen können die Motoraktivität je nach Kontext und dem spezifischen beteiligten Kinesin entweder verstärken oder hemmen. Beispielsweise inhibiert die Phosphorylierung von Kinesin-1 durch GSK3 dessen Fähigkeit, an Mikrotubuli zu binden, wodurch der axonale Transport in Neuronen reguliert wird.
Cargo-Adapterproteine verfeinern weiter die Kinesin-Regulation. Diese Adapter, wie JIP1 und Milton, verbinden Kinesine mit spezifischen Cargos und können die Motoraktivität modulieren, indem sie die aktive Konformation stabilisieren oder zusätzliche Regulatorfaktoren rekrutieren. Das Zusammenspiel zwischen Adapterproteinen und Motoren ermöglicht eine präzise räumliche und zeitliche Kontrolle über die Cargo-Lieferung, was insbesondere in hochpolarisierten Zellen wie Neuronen entscheidend ist.
Darüber hinaus können die Mikrotubuli selbst Kinesin-Aktivität beeinflussen. Mikrotubuli-assoziierte Proteine (MAPs) und posttranslationalen Modifikationen von Tubulin (wie Acetylierung oder Detyrosinierung) können die Bindungsaffinität und Motilität von Kinesinen verändern und somit deren Bewegung entlang spezifischer Mikrotubuli-Sätze lenken oder einschränken.
Die Regulation der Kinesin-Motorproteine ist ein Gegenstand laufender Forschung, mit Auswirkungen auf das Verständnis neurodegenerativer Erkrankungen, Krebs und Entwicklungsstörungen. Führende Organisationen wie die National Institutes of Health und die Nature Publishing Group unterstützen und verbreiten Forschungen auf diesem Gebiet und betonen die Bedeutung der Kinesin-Regulation für Gesundheit und Krankheit.
Kinesin in der neuronalen Funktion und axonalem Transport
Kinesin-Motorproteine sind eine Superfamilie von ATP-abhängigen molekularen Motoren, die eine zentrale Rolle im intrazellulären Transport spielen, insbesondere im hochpolarisierten Umfeld von Neuronen. Diese Proteine bewegen sich entlang von Mikrotubuli und wandeln chemische Energie aus der ATP-Hydrolyse in mechanische Arbeit um, was die gerichtete Bewegung verschiedener zellulärer Cargoe ermöglicht. In Neuronen sind Kinesine für den Transport von Organellen, Vorläufern synaptischer Vesikel, Proteinen und mRNAs vom Zellkörper (Soma) zum axonalen Ende, ein Prozess, der als anterograder axonaler Transport bezeichnet wird, unerlässlich.
Die Kinesin-Superfamilie ist vielfältig, mit über 40 verschiedenen Kinesin-Genen, die beim Menschen identifiziert wurden, von denen jedes Proteine mit spezialisierten Funktionen und Cargo-Spezifitäten kodiert. Das am besten charakterisierte Mitglied, Kinesin-1 (auch bekannt als konventionelles Kinesin), ist ein Heterotetramer, das aus zwei schweren Ketten und zwei leichten Ketten besteht. Die schweren Ketten enthalten die Motordomänen, die für die ATP-Hydrolyse und die Bindung an Mikrotubuli verantwortlich sind, während die leichten Ketten die Cargo-Erkennung und -Bindung vermitteln. Diese strukturelle Organisation ermöglicht es Kinesin-1, eine Vielzahl von Cargos zu transportieren, die entscheidend für die neuronale Funktion und das Überleben sind.
Der axonale Transport ist für die Aufrechterhaltung der neuronalen Gesundheit und Funktion von entscheidender Bedeutung, angesichts der extremen Länge einiger Axone, die bei Menschen bis zu einem Meter betragen können. Der von Kinesin gesteuerte anterograde Transport sorgt für die zeitgerechte Lieferung von synaptischen Komponenten, Mitochondrien und anderen wichtigen Organellen zu den distalen Regionen des Neurons. Eine Störung der Kinesin-Funktion kann zu Defiziten in der synaptischen Übertragung, axonaler Degeneration führen und wurde mit mehreren neurodegenerativen Erkrankungen, einschließlich Alzheimer-Krankheit und amyotropher Lateralsklerose (ALS), in Verbindung gebracht. Die Bedeutung des Kinesin-vermittelten Transports für die neuronale Gesundheit wird durch Forschungen führender wissenschaftlicher Organisationen wie der National Institutes of Health und des National Institute of Neurological Disorders and Stroke unterstrichen, die den Zusammenhang zwischen Defekten des axonalen Transports und Neurodegeneration hervorgehoben haben.
Neben dem anterograden Transport koordinieren Kinesine auch mit Dynein-Motorproteinen, die den retrograden Transport (vom axonalen Ende zurück zum Soma) vermitteln, um den bidirektionalen Fluss von Materialien zu gewährleisten, der für die neuronale Homöostase erforderlich ist. Die präzise Regulierung der Kinesin-Aktivität, der Auswahl von Cargos und die Koordination mit anderen Motorproteinen ist ein Gegenstand laufender Forschung, mit Auswirkungen auf das Verständnis der molekularen
Basis neuronaler Vernetzung, Plastizität und Erkrankungen.
Vergleichsanalyse: Kinesin vs. Dynein und Myosin
Kinesin-Motorproteine sind eine fundamentale Klasse von molekularen Motoren, die eine entscheidende Rolle im intrazellulären Transport spielen, besonders entlang von Mikrotubuli. Um ihre biologische Bedeutung vollständig zu verstehen, ist es entscheidend, Kinesine mit den beiden anderen Hauptfamilien von zytoskelettalen Motorproteinen – Dyneinen und Myosinen – zu vergleichen. Jede dieser Motorproteine ist spezialisiert auf die Bewegung entlang unterschiedlicher zytoskelettaler Filamente und ist für spezifische zelluläre Funktionen angepasst.
Kinesine und Dyneine durchqueren beide Mikrotubuli, unterscheiden sich aber in ihrer Richtung und Cargo-Spezifität. Kinesinen bewegen sich in der Regel in Richtung des Plus-Endes der Mikrotubuli, das typischerweise auf die Zellperipherie ausgerichtet ist, und erleichtern den anterograden Transport von Organellen, Vesikeln und Protein-Komplexen. Im Gegensatz dazu bewegen sich Dyneine in Richtung des Minus-Endes der Mikrotubuli und leiten Cargo in Richtung des Zellzentrums, wie den Zellkern oder das Mikrotubuli-organisierende Zentrum. Dieses bidirektionale System gewährleistet eine effiziente Verteilung und Wiederverwertung zellulärer Komponenten. Strukturell sind Kinesine typischerweise homodimerische oder heterodimerische Proteine mit zwei Motordomänen, während cytoplasmatische Dyneine große, multiuntereinheitliche Komplexe mit einem komplizierteren Mechanismus der Kraftgenerierung und Regulation sind (National Institute of Genetics).
Myosine hingegen sind vor allem aktinbasierte Motorproteine. Sie sind am bekanntesten für ihre Rolle bei der Muskelkontraktion, nehmen aber auch an einer Vielzahl von nicht-muskulären zellulären Prozessen teil, wie der Zytokinese, dem Vesikeltransport und der Zellmotilität. Im Gegensatz zu Kinesinen und Dyneinen, die sich entlang von Mikrotubuli bewegen, durchqueren Myosine Aktinfilamente, normalerweise in Richtung des Plus- (spitzen) Endes. Die strukturelle Organisation der Myosine ist unterschiedlich, mit einer charakteristischen Kopf-Domäne, die an Aktin bindet und ATP hydrolysiert, einem Nackenbereich und einem Schwanz, der die Cargo-Spezifität bestimmt (National Institutes of Health).
Funktionell sind die drei Motorprotein-Familien auf ihre jeweiligen zytoskelettalen Gleise und zellulären Rollen angepasst. Kinesinen sind entscheidend für den Langstrecken-, zielgerichteten Transport in Neuronen und sich teilenden Zellen, während Dyneinen für den retrograden Transport und ziliäre/flagellare Bewegung unerlässlich sind. Myosine hingegen sind zentral für Prozesse, die Kraftgenerierung und kurzreichweitigen Transport auf Aktin-Netzwerken erfordern. Das Zusammenspiel dieser Motoren gewährleistet die dynamische Organisation und Anpassungsfähigkeit der eukaryotischen Zelle.
Zusammenfassend lässt sich sagen, dass, obwohl Kinesine, Dyneine und Myosine die grundlegende Eigenschaft des Umwandelns chemischer Energie aus der ATP-Hydrolyse in mechanische Arbeit teilen, sie für unterschiedliche Gleise, Richtungen und zelluläre Funktionen spezialisiert sind. Ihre koordinierten Aktionen sind entscheidend für die Aufrechterhaltung der zellulären Architektur, Signalübertragung und Homöostase.
Kinesin-assoziierte Krankheiten und therapeutische Ziele
Kinesin-Motorproteine sind essentielle molekulare Maschinen, die verschiedene zelluläre Cargos entlang von Mikrotubuli transportieren und eine zentrale Rolle im intrazellulären Verkehr, in der Mitose und in der neuronalen Funktion spielen. Dysregulation oder Mutation von Kinesin-Genen wurde mit einer Reihe menschlicher Krankheiten in Verbindung gebracht, was diese Proteine sowohl als Biomarker als auch als potenzielle therapeutische Ziele erheblich macht.
Eine der am besten dokumentierten Krankheitsassoziationen betrifft das Kinesin-Familienmitglied KIF1A. Mutationen im KIF1A-Gen sind mit einem Spektrum von neurodegenerativen Erkrankungen verknüpft, die zusammen als KIF1A-assoziierte neurologische Störung (KAND) bezeichnet werden. Diese Zustände äußern sich in intellektuellen Behinderungen, spastischer Paraplegie und progressiver Neurodegeneration. Die zugrunde liegende Pathologie wird häufig auf den gestörten axonalen Transport zurückgeführt, der die synaptische Funktion und neuronale Überlebensfähigkeit stört. In ähnlicher Weise werden Mutationen in anderen Kinesin-Genen, wie KIF5A und KIF21A, mit hereditärer spastischer Paraplegie bzw. kongenitaler Fibrose der äußeren Augenmuskeln in Verbindung gebracht, was die kritische Rolle der Kinesine in der Gesundheit des Nervensystems weiter unterstreicht.
Neben der Neurodegeneration sind Kinesin-Motorproteine auch an Krebs beteiligt. Beispielsweise ist KIF11 (auch bekannt als Eg5) für die Bildung des mitotischen Spindels während der Zellteilung unerlässlich. Eine Überexpression oder Hyperaktivität von KIF11 wurde in verschiedenen Krebsarten wie Brust- und Prostatakrebs beobachtet, wo sie zur unkontrollierten Zellproliferation beiträgt. Daher hat sich KIF11 als vielversprechendes Ziel für anti-mitotische Krebstherapien herausgestellt. Mehrere niedermolekulare Inhibitoren von KIF11, wie Ispinesib, haben klinische Studien erreicht, die darauf abzielen, die Zellteilung von Krebszellen selektiv zu stören, während normale Zellen geschont werden. Die Entwicklung und Evaluierung dieser Inhibitoren wird von Aufsichts- und Forschungsorganisationen wie dem National Cancer Institute und der U.S. Food and Drug Administration genau überwacht.
Therapeutische Strategien, die auf Kinesin-Motorproteine abzielen, gehen über die Onkologie hinaus. In neurodegenerativen Erkrankungen werden Moleküle entwickelt, die die Kinesin-Funktion wiederherstellen oder modulieren können, um potenziell Defizite im axonalen Transport zu mildern. Darüber hinaus erforscht die von Organisationen wie den National Institutes of Health unterstützte Forschung Gentherapie und niedermolekulare Ansätze, um eine korrigierende oder kompensatorische Wirkung für defekte Kinesin-Aktivität in genetischen Störungen zu erreichen.
Zusammenfassend sind Kinesin-Motorproteine zentral für die zelluläre Gesundheit, und ihre Dysfunktion wird mit einer Vielzahl von Krankheiten, insbesondere im Nervensystem und bei Krebs, in Verbindung gebracht. Laufende Forschungs- und klinische Entwicklungsbemühungen untersuchen weiterhin Kinesine sowohl als Biomarker als auch als therapeutische Ziele, mit dem Potenzial, neuartige Behandlungen für derzeit schwer behandelbare Zustände zu bieten.
Aufkommende Forschung und zukünftige Richtungen
Die aufkommende Forschung zu Kinesin-Motorproteinen erweitert schnell unser Verständnis ihrer Rollen in zellulären Prozessen und ihrer potenziellen Anwendungen in Biotechnologie und Medizin. Kinesine sind eine Superfamilie von ATP-abhängigen molekularen Motoren, die Cargo entlang von Mikrotubuli transportieren und essentielle Rollen im intrazellulären Verkehr, in der Mitose und in der neuronalen Funktion spielen. Jüngste Fortschritte in der hochauflösenden Bildgebung und der Einzelmolekülbiophysik haben es Forschern ermöglicht, die Dynamik von Kinesinen in beispiellosem Detail zu visualisieren, und neue Einblicke in ihre mechanochemischen Zyklen und regulatorischen Mechanismen offenbart.
Eine vielversprechende Richtung betrifft die Aufklärung der strukturellen Diversität von Kinesin und deren Implikationen für Cargo-Spezifität und Regulation. Techniken der strukturellen Biologie, wie die Kryo-Elektronenmikroskopie, haben verschiedene Konformationszustände von Kinesin-Familienmitgliedern aufgedeckt und dadurch auf spezialisierte Anpassungen für unterschiedliche zelluläre Aufgaben hingewiesen. Dieses strukturelle Wissen informiert das Design von kleinen Molekülen und Peptiden, die die Kinesin-Aktivität modulieren können, mit potenziellen therapeutischen Anwendungen in neurodegenerativen Krankheiten und Krebs, wo abnormale Kinesin-Funktionen in der Krankheitsentstehung impliziert sind.
Die synthetische Biologie nutzt auch Kinesin-Motoren zur Konstruktion von nanoskaligen Transportsystemen. Durch die Nutzung der gerichteten Bewegung von Kinesinen entwickeln Forscher biomimetische Geräte für die gezielte Medikamentenabgabe und molekulare Assemblierung. Diese Innovationen könnten die Präzisionsmedizin revolutionieren, indem sie den kontrollierten Transport therapeutischer Wirkstoffe innerhalb von Zellen oder Geweben ermöglichen.
Ein weiteres aufkommendes Gebiet ist die Untersuchung der Rolle von Kinesin in der neuronalen Gesundheit und Erkrankungen. Mutationen in Kinesin-Genen wurden mit hereditärer spastischer Paraplegie, Charcot-Marie-Tooth-Krankheit und anderen neurodegenerativen Erkrankungen in Verbindung gebracht. Laufende Forschungen zielen darauf ab, zu klären, wie diese Mutationen den axonalen Transport stören und Strategien zur Wiederherstellung der normalen Funktion zu identifizieren. Die National Institutes of Health und das National Institute of Neurological Disorders and Stroke unterstützen Initiativen zur Untersuchung der molekularen Grundlagen dieser Krankheiten und zur Entwicklung gezielter Interventionen.
Ausblickend wird erwartet, dass die Integration von computergestützten Modellen, fortschrittlicher Mikroskopie und Technologien zur Genbearbeitung die Entdeckungen im Bereich der Kinesin-Biologie beschleunigt. Gemeinschaftliche Bemühungen zwischen akademischen Institutionen, Regierungsbehörden und Biotechnologieunternehmen fördern die Übersetzung der Grundlagenforschung in klinische und industrielle Anwendungen. Während unser Verständnis der Kinesin-Motorproteine vertieft wird, werden neue Möglichkeiten entstehen, um den intrazellulären Transport zu manipulieren, Krankheiten zu diagnostizieren und innovative therapeutische Strategien zu entwerfen.
Quellen & Referenzen
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute