Proteínas Motores Kinesina: Los Motores Dinámicos que Impulsan la Logística Intracelular. Descubre Cómo Estas Máquinas Moleculares Revolucionan la Función y Salud Celular.
- Introducción a las Proteínas Motores Kinesina
- Estructura Molecular y Mecanismo de Acción
- Hidrolisis de ATP y Conversión de Energía
- Reconocimiento de Carga y Especificidad de Unión
- Vías de Transporte Intracelular
- Regulación de la Actividad Kinesina
- Kinesina en la Función Neuronal y Transporte Axonal
- Análisis Comparativo: Kinesina vs. Dineina y Miosina
- Enfermedades Relacionadas con Kinesinas y Objetivos Terapéuticos
- Investigaciones Emergentes y Direcciones Futuras
- Fuentes y Referencias
Introducción a las Proteínas Motores Kinesina
Las proteínas motoras kinesina son una clase fundamental de motores moleculares que juegan un papel crítico en el transporte intracelular y la organización celular. Descubiertas a mediados de la década de 1980, las kinesinas son proteínas dependientes de ATP que se desplazan a lo largo de vías de microtúbulos dentro de células eucariotas, transportando una variedad de cargas como orgánulos, vesículas, proteínas y RNA mensajero. Este transporte es esencial para numerosos procesos celulares, incluyendo mitosis, meiosis y función neuronal. La superfamilia de kinesinas es amplia y diversa, con más de 40 genes de kinesina diferentes identificados en humanos, cada uno codificando proteínas con funciones especializadas y especificidades de carga.
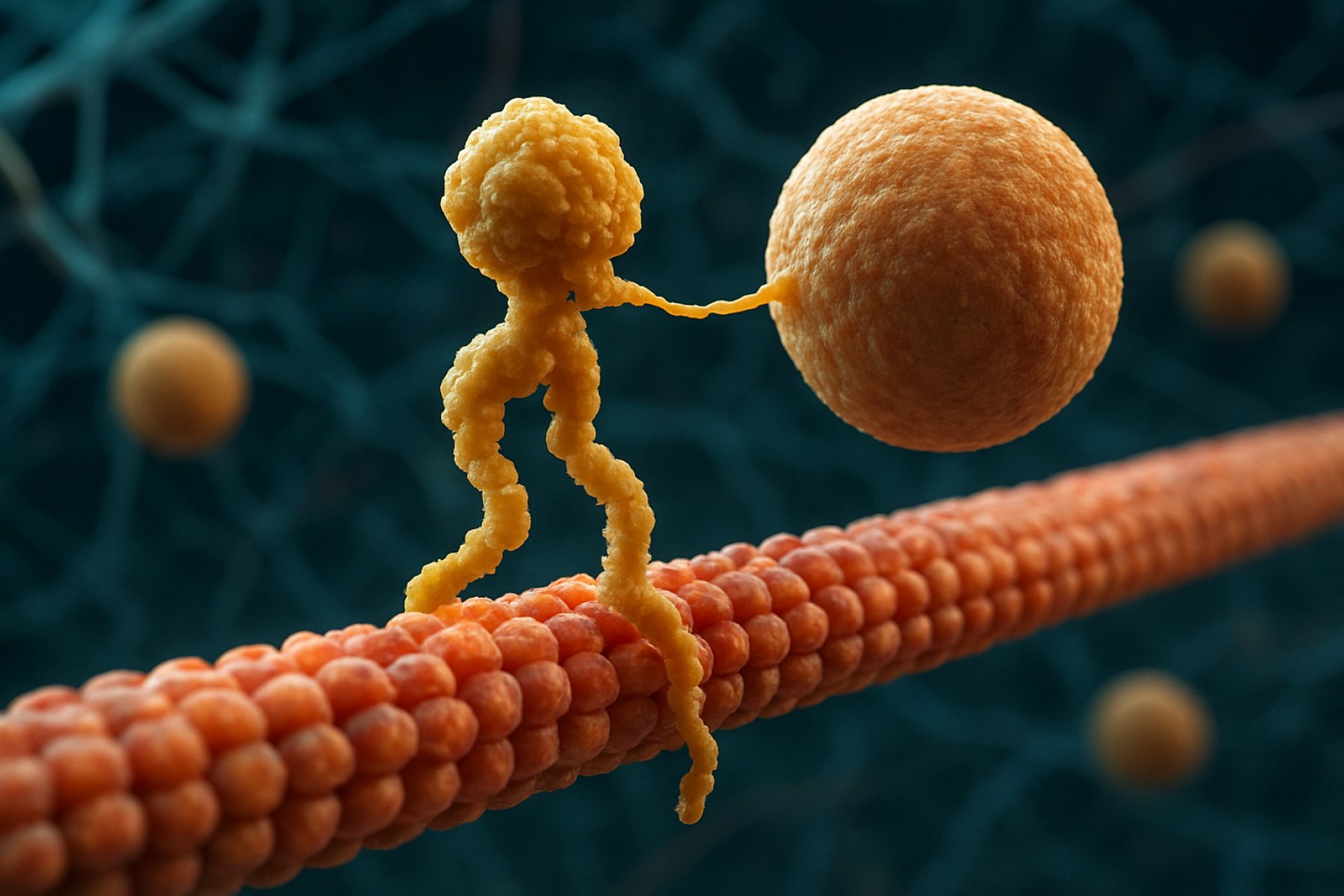
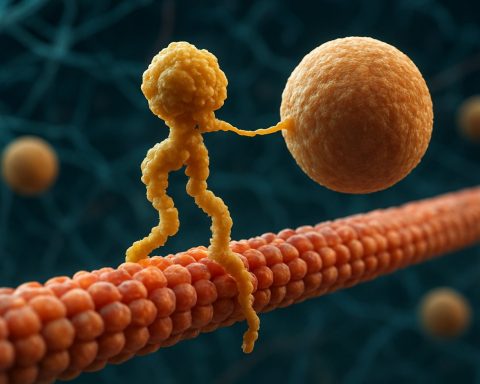
Estructuralmente, las kinesinas están compuestas típicamente por dos cadenas pesadas y dos cadenas ligeras. Las cadenas pesadas contienen un dominio motor conservado, que se une a los microtúbulos y hidroliza ATP para generar movimiento. Los dominios de cola de las kinesinas son responsables de la unión de cargas, lo que permite al motor transportar componentes celulares específicos a sus destinos previstos. El movimiento de la kinesina se dirige generalmente hacia el extremo positivo de los microtúbulos, que generalmente corresponde a la periferia celular, aunque algunos miembros de la familia de kinesinas se mueven hacia el extremo negativo.
El mecanismo de movimiento de la kinesina se describe a menudo como un movimiento de «mano sobre mano», donde los dos dominios motores se unen y liberan alternadamente el microtúbulo, impulsados por ciclos de unión y hidrolisis de ATP. Este movimiento procesivo permite a las kinesinas recorrer largas distancias a lo largo de los microtúbulos sin despegar, lo que las convierte en transportadoras altamente eficientes dentro del ambiente celular abarrotado. La regulación precisa de la actividad de la kinesina es crucial para mantener la homeostasis y función celular.
Las proteínas motoras kinesina no solo son vitales para las operaciones celulares normales, sino que también están implicadas en diversas enfermedades. Los defectos en la función de las kinesinas se han relacionado con trastornos neurodegenerativos, como la enfermedad de Alzheimer y la paraplejía espástica hereditaria, así como con ciertos tipos de cáncer. Como resultado, las kinesinas son objeto de intensa investigación, tanto para comprender su biología básica como para explorar su potencial como objetivos terapéuticos.
La investigación sobre las proteínas motoras kinesina es apoyada y promovida por organizaciones científicas líderes e institutos de investigación en todo el mundo, incluyendo los Institutos Nacionales de Salud y el Grupo de Publicaciones Nature, que publican regularmente estudios revisados por pares sobre la estructura, función y significancia biomédica de estas proteínas. El estudio continuo de las kinesinas sigue revelando nuevos conocimientos sobre la maquinaria molecular de la vida y ofrece caminos prometedores para el desarrollo de nuevas intervenciones médicas.
Estructura Molecular y Mecanismo de Acción
Las proteínas motoras kinesina son una superfamilia de motores moleculares dependientes de ATP que juegan un papel crucial en el transporte intracelular, particularmente a lo largo de vías de microtúbulos. Estructuralmente, las kinesinas están compuestas típicamente por dos cadenas pesadas y dos cadenas ligeras, formando un complejo heterotetramérico. Las cadenas pesadas contienen un dominio motor N-terminal altamente conservado (también llamado «cabeza»), un tallo en hélice y un dominio de cola C-terminal. El dominio motor es responsable de unirse a los microtúbulos y hidrolizar ATP, lo que proporciona la energía necesaria para el movimiento. En contraste, el dominio de cola está involucrado en el reconocimiento y la unión de la carga, a menudo interactuando con proteínas adaptadoras o directamente con vesículas y orgánulos.
El mecanismo de acción de las proteínas motoras kinesina se describe a menudo como un movimiento de «mano sobre mano». Cada molécula de kinesina tiene dos dominios motores que se unen y se liberan alternadamente del microtúbulo, coordinados por la unión y la hidrolisis de ATP. Cuando una cabeza se une al microtúbulo y hidroliza ATP, sufre un cambio conformacional que impulsa la otra cabeza hacia adelante hasta el siguiente sitio de unión, aproximadamente 8 nanómetros más allá. Este proceso se repite, permitiendo que la kinesina «camine» unidireccionalmente a lo largo del microtúbulo, generalmente hacia el extremo positivo, que está orientado hacia la periferia celular. La acción coordinada de las dos cabezas asegura la procesividad, lo que significa que la kinesina puede dar muchos pasos a lo largo de un microtúbulo sin disociarse, lo cual es esencial para el transporte eficiente de cargas a largas distancias dentro de la célula.
Las kinesinas son altamente diversas, con más de 40 genes diferentes de kinesina identificados en humanos, cada uno adaptado para funciones celulares específicas. Si bien la mayoría de las kinesinas se mueven hacia el extremo positivo de los microtúbulos, algunas, como los miembros de la familia kinesina-14, se mueven hacia el extremo negativo, destacando la versatilidad funcional de esta familia de proteínas. La actividad y dirección de las kinesinas están determinadas por diferencias sutiles en sus dominios motores y regiones reguladoras asociadas.
El estudio de la estructura y función de las kinesinas ha avanzado gracias a técnicas de alta resolución como la cristalografía de rayos X y la microscopía crio-electrónica, que han revelado conocimientos detallados sobre los cambios conformacionales que subyacen a su motilidad. Estos hallazgos han sido fundamentales para comprender no solo la biología celular básica, sino también la base molecular de las enfermedades vinculadas a la disfunción de las kinesinas, como ciertos trastornos neurodegenerativos y cánceres. Organizaciones de investigación líderes, incluidos los Institutos Nacionales de Salud y el Laboratorio Europeo de Biología Molecular, continúan investigando los mecanismos moleculares de las proteínas motoras kinesina, subrayando su importancia fundamental en la biología celular.
Hidrolisis de ATP y Conversión de Energía
Las proteínas motoras kinesina son máquinas moleculares esenciales que convierten energía química en trabajo mecánico, permitiendo el transporte de varias cargas celulares a lo largo de los microtúbulos. El proceso fundamental que subyace a este movimiento es la hidrolisis de trifosfato de adenosina (ATP), que proporciona la energía requerida para los cambios conformacionales y la motilidad direccional de kinesina.
La hidrolisis de ATP ocurre en los dominios motores (también llamados «cabezas») del dímero de kinesina. Cada cabeza contiene un sitio de unión de nucleótidos altamente conservado que alterna entre unirse y hidrolizar ATP. El ciclo mecanicoquímico comienza cuando una cabeza de kinesina, fuertemente unida al microtúbulo, se une a ATP. Esta unión induce un cambio conformacional en la región del conector del cuello, impulsando la cabeza trasera hacia adelante en un movimiento de «mano sobre mano». A medida que la cabeza principal se une a la siguiente subunidad de tubulina, ATP se hidroliza a adenosina difosfato (ADP) y fosfato inorgánico (Pi), liberando energía que se transduce en movimiento mecánico. La liberación de Pi y el posterior intercambio de ADP por ATP reinician el ciclo, permitiendo un movimiento procesivo continuo a lo largo del microtúbulo.
La eficiencia de conversión de energía en kinesina es notable. Cada molécula de ATP hidrolizada resulta en un paso de 8 nanómetros a lo largo del microtúbulo, con mínima pérdida de energía. Esta alta eficiencia se atribuye al acoplamiento estrecho entre la hidrolisis de ATP y el mecanismo de paso mecánico. El proceso está altamente regulado, asegurando que la hidrolisis de ATP solo ocurra cuando la cabeza de kinesina está correctamente comprometida con el microtúbulo, previniendo así el gasto energético innecesario.
La actividad ATPasa de kinesina también se modula por la presencia de carga y el tipo específico de miembro de la familia kinesina involucrado. Por ejemplo, la kinesina convencional-1 es altamente procesiva, capaz de dar cientos de pasos sin disociarse del microtúbulo, mientras que otros miembros de la familia de kinesinas pueden tener diferentes tasas de hidrolisis de ATP y comportamientos de paso, adaptados a sus funciones celulares.
El estudio de la hidrolisis de ATP y la conversión de energía en kinesina ha sido fundamental para comprender los mecanismos de transporte intracelular y los principios más amplios de la función de los motores moleculares. La investigación en esta área es apoyada por organizaciones científicas líderes como los Institutos Nacionales de Salud y la Fundación Nacional de Ciencias, que financian investigaciones sobre la biología estructural y la biofísica de las proteínas motoras. Los conocimientos obtenidos a partir de estos estudios tienen implicaciones para la neurobiología, la división celular y el desarrollo de aplicaciones nanotecnológicas que imiten motores biológicos.
Reconocimiento de Carga y Especificidad de Unión
Las proteínas motoras kinesina son máquinas moleculares esenciales que transportan una amplia variedad de cargas intracelulares a lo largo de vías microtubulares, desempeñando un papel crucial en procesos como la posición de orgánulos, el tráfico de vesículas y la mitosis. La especificidad con la que las kinesinas reconocen y se unen a su carga es fundamental para la fidelidad y regulación del transporte intracelular. Esta especificidad se logra a través de una combinación de características estructurales, proteínas adaptadoras y mecanismos reguladores.
La superfamilia de kinesinas se caracteriza por un dominio motor conservado responsable de la hidrolisis de ATP y la unión a los microtúbulos, pero las funciones de reconocimiento y unión de carga son principalmente mediadas por los dominios de cola variables. Estas regiones de cola difieren significativamente entre los miembros de la familia kinesina, permitiendo la interacción selectiva con cargas distintas. Por ejemplo, la kinesina-1 (también conocida como kinesina convencional) utiliza su cola C-terminal para unirse a una variedad de cargas, incluidos orgánulos unidos a membranas y vesículas, a menudo a través de proteínas adaptadoras como las cadenas ligeras de kinesina (KLCs). Las KLCs contienen motivos de repetición de tetratricopeptidos (TPR) que facilitan el reconocimiento de proteínas específicas asociadas con la carga, confiriendo así selectividad al proceso de transporte.
Las proteínas adaptadoras desempeñan un papel crucial en la unión de las kinesinas a sus cargas. Estas adaptadoras pueden reconocer señales o motivos específicos en la superficie de la carga, asegurando que solo la carga apropiada sea transportada por una kinesina dada. Por ejemplo, la interacción entre las KLCs y miembros de la familia JIP (proteína de interacción con quinasa N-terminal c-Jun) está bien documentada en el transporte neuronal, donde las JIPs actúan como andamiajes que enlazan kinesina-1 con vesículas que contienen moléculas de señalización. Otros miembros de la familia kinesina, como la kinesina-3, utilizan adaptadores diferentes y estructuras de dominio de cola para lograr especificidad de carga, reflejando la diversidad de cargas y contextos celulares en los que operan las kinesinas.
La regulación de la unión de carga también se logra mediante modificaciones post-traducionales e interacciones competitivas. La fosforilación de colas de kinesina o de proteínas adaptadoras puede modular la afinidad de unión, permitiendo un control dinámico sobre la unión y liberación de carga en respuesta a señales celulares. Además, algunas cargas pueden competir por unirse a la misma kinesina, introduciendo otra capa de regulación que asegura una distribución adecuada de la carga.
El estudio del reconocimiento de carga y la especificidad de unión en las proteínas motoras kinesina es un campo en rápida evolución, con implicaciones para la comprensión de enfermedades neurodegenerativas, trastornos del tráfico intracelular y el desarrollo de terapias específicas. Organizaciones de investigación líderes como los Institutos Nacionales de Salud y la Organización Europea de Biología Molecular apoyan investigaciones en curso sobre los mecanismos moleculares que subyacen a las interacciones kinesina-carga, destacando la significancia biomédica de esta área.
Vías de Transporte Intracelular
Las proteínas motoras kinesina son máquinas moleculares esenciales que impulsan el transporte intracelular a lo largo de vías microtubulares, asegurando la entrega precisa de orgánulos, vesículas, proteínas y otras cargas dentro de las células eucariotas. Estos motores dependientes de ATP se caracterizan por su capacidad para convertir energía química en trabajo mecánico, facilitando el movimiento de componentes celulares a largas distancias con notable direccionalidad y especificidad.
Estructuralmente, las kinesinas consisten típicamente en dos cadenas pesadas que forman un dímero, cada una con un dominio motor globular (cabeza) que se une a los microtúbulos y hidroliza ATP. Los dominios de cola son responsables del reconocimiento y la unión de carga, a menudo en asociación con cadenas ligeras o proteínas adaptadoras. El miembro más estudiado, la kinesina-1, se mueve predominantemente hacia el extremo positivo de los microtúbulos, que generalmente corresponde a la periferia celular, desempeñando así un papel crucial en el transporte anterógrado.
El mecanismo de movimiento de las kinesinas se describe a menudo como un movimiento de «mano sobre mano», donde los dos dominios motores se unen y avanzan alternativamente a lo largo de la red de microtúbulos. Cada paso está estrechamente acoplado a la hidrolisis de una sola molécula de ATP, asegurando procesividad y direccionalidad. Este movimiento coordinado permite a las kinesinas transportar cargas a través de distancias que pueden abarcar toda la longitud de una neurona u otros tipos de células grandes.
Las kinesinas se clasifican en múltiples familias basadas en la homología de secuencia y la especialización funcional. Mientras que la kinesina-1 está principalmente involucrada en el transporte de orgánulos y vesículas, otras familias como la kinesina-2 y la kinesina-3 tienen roles distintos en el transporte ciliar y el tráfico de vesículas sinápticas, respectivamente. Algunas kinesinas, como la kinesina-5, están involucradas en la dinámica del huso mitótico en lugar de en el transporte de carga, destacando la diversidad funcional dentro de esta superfamilia de proteínas.
La actividad de los motores kinesina está estrechamente regulada por vías de señalización celular, modificaciones post-traducionales e interacciones con proteínas asociadas a microtúbulos. Esta regulación asegura que las cargas se entreguen a las ubicaciones subcelulares correctas en respuesta a necesidades fisiológicas. La interrupción del transporte mediado por kinesina se ha implicado en diversas enfermedades, incluidos trastornos neurodegenerativos, donde el transporte axonal defectuoso contribuye a la disfunción y degeneración neuronal.
La investigación sobre las proteínas motoras kinesina continúa avanzando nuestra comprensión de la logística celular e inspira el desarrollo de dispositivos nanobiomiméticos. Organizaciones científicas líderes como los Institutos Nacionales de Salud y el Grupo de Publicaciones Nature publican regularmente estudios fundamentales y revisiones sobre la estructura, función y significancia biomédica de los motores kinesina, subrayando su papel central en la biología celular.
Regulación de la Actividad Kinesina
Las proteínas motoras kinesina son máquinas moleculares esenciales que transportan cargas a lo largo de microtúbulos dentro de células eucariotas. La regulación de la actividad de la kinesina es crucial para mantener la organización celular, garantizar la distribución adecuada de orgánulos y apoyar procesos como la mitosis y la función neuronal. Existen múltiples capas de regulación para controlar cuándo, dónde y cómo las kinesinas interactúan con sus cargas y las vías de microtúbulos.
Un mecanismo primario de regulación es a través de la autoinhibición. Muchos miembros de la familia kinesina, como la kinesina-1, poseen dominios de cola que pueden doblarse hacia atrás e interactuar con sus dominios motores, impidiendo la actividad ATPasa y la unión a microtúbulos en ausencia de carga. Esta conformación autoinhibida se libera tras la unión de la carga, lo que induce un cambio conformacional que activa el motor para el movimiento procesivo. Este mecanismo asegura que las kinesinas estén activas solo cuando son necesarias, previniendo el consumo innecesario de ATP y el potencial daño celular.
Las modificaciones post-traducionales (PTMs) también juegan un papel significativo en la modulación de la actividad de la kinesina. La fosforilación es la PTM más estudiada, con quinasas como las quinasas dependientes de ciclina (CDKs) y la quina de síntesis de glucógeno 3 (GSK3) fosforilando residuos específicos en proteínas kinesina. Estas modificaciones pueden mejorar o inhibir la actividad del motor, dependiendo del contexto y de la kinesina específica involucrada. Por ejemplo, la fosforilación de la kinesina-1 por GSK3 inhibe su capacidad para unirse a los microtúbulos, regulando así el transporte axonal en neuronas.
Las proteínas adaptadoras de carga refinan aún más la regulación de las kinesinas. Estas adaptadoras, como JIP1 y Milton, vinculan a las kinesinas con cargas específicas y pueden modular la actividad del motor estabilizando la conformación activa o reclutando factores reguladores adicionales. La interacción entre adaptadores y motores permite un control preciso del espacio y el tiempo de entrega de cargas, lo que es especialmente crítico en células altamente polarizadas como las neuronas.
Además, las propias vías de microtúbulos pueden influir en la actividad de la kinesina. Las proteínas asociadas a microtúbulos (MAPs) y las modificaciones post-traducionales de la tubulina (como la acetilación o la des-Tyrosinación) pueden alterar la afinidad de unión y la motilidad de las kinesinas, guiando o restringiendo efectivamente su movimiento a lo largo de subconjuntos específicos de microtúbulos.
La regulación de las proteínas motoras kinesina es un tema de investigación en curso, con implicaciones para comprender enfermedades neurodegenerativas, cáncer y trastornos del desarrollo. Organizaciones líderes como los Institutos Nacionales de Salud y el Grupo de Publicaciones Nature apoyan y difunden investigaciones en este campo, destacando la importancia de la regulación de las kinesinas en la salud y la enfermedad.
Kinesina en la Función Neuronal y Transporte Axonal
Las proteínas motoras kinesina son una superfamilia de motores moleculares dependientes de ATP que desempeñan un papel fundamental en el transporte intracelular, particularmente dentro del entorno altamente polarizado de las neuronas. Estas proteínas se desplazan a lo largo de vías de microtúbulos, convirtiendo la energía química de la hidrolisis de ATP en trabajo mecánico, lo que permite el movimiento dirigido de diversas cargas celulares. En neuronas, las kinesinas son esenciales para el transporte de orgánulos, precursores de vesículas sinápticas, proteínas y mRNAs desde el cuerpo celular (soma) hasta el terminal axonal, un proceso conocido como transporte axonal anterógrado.
La superfamilia de kinesinas es diversa, con más de 40 genes de kinesina diferentes identificados en humanos, cada uno codificando proteínas con funciones especializadas y especificidades de carga. El miembro más caracterizado, la kinesina-1 (también conocida como kinesina convencional), es un heterotetámero compuesto por dos cadenas pesadas y dos cadenas ligeras. Las cadenas pesadas contienen los dominios motores responsables de la hidrolisis de ATP y la unión a microtúbulos, mientras que las cadenas ligeras median el reconocimiento y la unión de carga. Esta organización estructural permite a la kinesina-1 transportar una amplia variedad de cargas críticas para la función y supervivencia neuronal.
El transporte axonal es vital para mantener la salud y función neuronal, dada la extrema longitud de algunos axones, que pueden extenderse hasta un metro en humanos. El transporte anterógrado impulsado por kinesina asegura la entrega oportuna de componentes sinápticos, mitocondrias y otros orgánulos esenciales a regiones distales de la neurona. La interrupción de la función de las kinesinas puede llevar a déficits en la transmisión sináptica, degeneración axonal, y se ha implicado en varias enfermedades neurodegenerativas, incluida la enfermedad de Alzheimer y la esclerosis lateral amiotrófica (ELA). La importancia del transporte mediado por kinesinas en la salud neuronal se ve subrayada por la investigación de organizaciones científicas líderes como los Institutos Nacionales de Salud y el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares, que han resaltado el vínculo entre los defectos en el transporte axonal y la neurodegeneración.
Además del transporte anterógrado, las kinesinas también coordinan con las proteínas motoras dineina, que median el transporte retrógrado (desde el terminal axonal de vuelta al soma), para mantener el flujo bidireccional de materiales necesario para la homeostasis neuronal. La regulación precisa de la actividad de la kinesina, la selección de carga y la coordinación con otras proteínas motoras es un tema de investigación en curso, con implicaciones para comprender la base molecular de la conectividad neuronal, la plasticidad y la enfermedad.
Análisis Comparativo: Kinesina vs. Dineina y Miosina
Las proteínas motoras kinesina son una clase fundamental de motores moleculares que desempeñan un papel crítico en el transporte intracelular, particularmente a lo largo de vías microtubulares. Para apreciar completamente su significancia biológica, es esencial comparar las kinesinas con las otras dos grandes familias de proteínas motoras citoesqueléticas: las dineínas y las miosinas. Cada una de estas proteínas motoras está especializada para el movimiento a lo largo de filamentos citoesqueléticos distintos y está adaptada para funciones celulares específicas.
Las kinesinas y las dineínas atraviesan ambos microtúbulos, pero difieren en su direccionalidad y especificidad de carga. Las kinesinas generalmente se mueven hacia el extremo positivo de los microtúbulos, que típicamente está orientado hacia la periferia celular, facilitando el transporte anterógrado de orgánulos, vesículas y complejos proteicos. En contraste, las dineínas se mueven hacia el extremo negativo de los microtúbulos, dirigiendo la carga hacia el centro celular, como el núcleo o el centro organizador de microtúbulos. Este sistema bidireccional asegura la distribución y reciclaje eficiente de los componentes celulares. Estructuralmente, las kinesinas son típicamente proteínas homodiméricas o heterodiméricas con dos dominios motores, mientras que las dineínas citoplasmáticas son complejos grandes y multisuunitarios con un mecanismo más intrincado de generación de fuerza y regulación (Instituto Nacional de Genética).
Las miosinas, por otro lado, son principalmente proteínas motoras basadas en actina. Son mejor conocidas por su papel en la contracción muscular, pero también participan en una variedad de procesos celulares no musculares, como la citocinesis, el transporte de vesículas y la motilidad celular. A diferencia de las kinesinas y dineínas, que se mueven a lo largo de microtúbulos, las miosinas atraviesan filamentos de actina, usualmente hacia el extremo positivo (cornete). La organización estructural de las miosinas es distinta, con un dominio de cabeza característico que se une a la actina y hidroliza ATP, una región de cuello y una cola que determina la especificidad de carga (Institutos Nacionales de Salud).
Funcionalmente, las tres familias de proteínas motoras están adaptadas a sus respectivas rutas citoesqueléticas y roles celulares. Las kinesinas son cruciales para el transporte direccional y a larga distancia en neuronas y células en división, mientras que las dineínas son esenciales para el transporte retrógrado y el movimiento ciliar/flagelar. Las miosinas, en contraste, son centrales en procesos que requieren generación de fuerza y transporte a corta distancia en redes de actina. La interacción entre estos motores asegura la organización dinámica y adaptabilidad de la célula eucariota.
En resumen, aunque las kinesinas, dineínas y miosinas comparten la propiedad fundamental de convertir energía química de la hidrolisis de ATP en trabajo mecánico, están especializadas para diferentes rutas, direcciones y funciones celulares. Sus acciones coordinadas son vitales para mantener la arquitectura celular, la señalización y la homeostasis.
Enfermedades Relacionadas con Kinesinas y Objetivos Terapéuticos
Las proteínas motoras kinesina son máquinas moleculares esenciales que transportan diversas cargas celulares a lo largo de microtúbulos, desempeñando un papel clave en el tráfico intracelular, la mitosis y la función neuronal. La desregulación o mutación de los genes de kinesina se ha implicado en una gama de enfermedades humanas, lo que hace que estas proteínas sean significativas tanto como biomarcadores como posibles objetivos terapéuticos.
Una de las asociaciones de enfermedades más documentadas involucra al miembro de la familia de kinesina KIF1A. Las mutaciones en el gen KIF1A están vinculadas a un espectro de trastornos neurodegenerativos, denominados colectivamente trastorno neurológico asociado con KIF1A (KAND). Estas condiciones se manifiestan como discapacidad intelectual, paraplejía espástica y neurodegeneración progresiva. La patología subyacente se atribuye a menudo a un transporte axonal comprometido, que interrumpe la función sináptica y la supervivencia neuronal. De manera similar, las mutaciones en otros genes de kinesina, como KIF5A y KIF21A, están asociadas con paraplejía espástica hereditaria y fibrosis congénita de los músculos extraoculares, respectivamente, subrayando aún más el papel crítico de las kinesinas en la salud del sistema nervioso.
Más allá de la neurodegeneración, las proteínas motoras kinesina también están implicadas en el cáncer. Por ejemplo, KIF11 (también conocido como Eg5) es esencial para la formación del huso mitótico durante la división celular. La sobreexpresión o hiperactividad de KIF11 se ha observado en varios cánceres, incluidos el cáncer de mama y de próstata, donde contribuye a la proliferación celular descontrolada. Como resultado, KIF11 ha surgido como un objetivo prometedor para terapias anticancerígenas anti-mitóticas. Varios inhibidores de pequeñas moléculas de KIF11, como el ispinesib, han ingresado a ensayos clínicos, con el objetivo de interrumpir selectivamente la división celular cancerosa mientras se preservan las células normales. El desarrollo y evaluación de estos inhibidores están bajo un monitoraje cercano por parte de organizaciones regulatorias y de investigación como el Instituto Nacional del Cáncer y la Administración de Alimentos y Medicamentos de EE. UU.
Las estrategias terapéuticas dirigidas a las proteínas motoras kinesina se extienden más allá de la oncología. En enfermedades neurodegenerativas, se están llevando a cabo esfuerzos para desarrollar moléculas que puedan restaurar o modular la función de las kinesinas, potencialmente mejorando los déficits en el transporte axonal. Además, investigaciones apoyadas por organizaciones como los Institutos Nacionales de Salud están explorando enfoques de terapia génica y pequeñas moléculas para corregir o compensar la actividad defectuosa de las kinesinas en trastornos genéticos.
En resumen, las proteínas motoras kinesina son centrales para la salud celular, y su disfunción está vinculada a una variedad de enfermedades, particularmente en el sistema nervioso y en el cáncer. Los esfuerzos de investigación y desarrollo clínico continúan explorando las kinesinas como biomarcadores y objetivos terapéuticos, con el potencial de generar tratamientos novedosos para condiciones actualmente intratables.
Investigaciones Emergentes y Direcciones Futuras
Las investigaciones emergentes sobre las proteínas motoras kinesina están ampliando rápidamente nuestra comprensión de sus roles en los procesos celulares y sus aplicaciones potenciales en biotecnología y medicina. Las kinesinas son una superfamilia de motores moleculares dependientes de ATP que transportan cargas a lo largo de microtúbulos, desempeñando roles esenciales en el tráfico intracelular, la mitosis y la función neuronal. Los recientes avances en imágenes de alta resolución y biophysics de moléculas individuales han permitido a los investigadores visualizar la dinámica de las kinesinas con un detalle sin precedentes, revelando nuevos conocimientos sobre sus ciclos mecanicoquímicos y mecanismos regulatorios.
Una dirección prometedora involucra la elucidación de la diversidad estructural de las kinesinas y sus implicaciones para la especificidad de carga y regulación. Las técnicas de biología estructural, como la microscopía crio-electrónica, han descubierto estados conformacionales distintos de los miembros de la familia kinesina, sugiriendo adaptaciones especializadas para diversas tareas celulares. Este conocimiento estructural está informando el diseño de pequeñas moléculas y péptidos que pueden modular la actividad de las kinesinas, con aplicaciones terapéuticas potenciales en enfermedades neurodegenerativas y cáncer, donde la función alterada de las kinesinas se implica en la patogénesis.
La biología sintética también está aprovechando los motores de kinesina para construir sistemas de transporte a nanoescala. Al aprovechar el movimiento direccional de las kinesinas, los investigadores están desarrollando dispositivos biomiméticos para la entrega dirigida de fármacos y el ensamblaje molecular. Estas innovaciones podrían revolucionar la medicina de precisión al permitir el transporte controlado de agentes terapéuticos dentro de células o tejidos.
Otra área emergente es el estudio del papel de las kinesinas en la salud y enfermedad neuronal. Las mutaciones en los genes de kinesina se han vinculado a paraplejía espástica hereditaria, enfermedad de Charcot-Marie-Tooth y otros trastornos neurodegenerativos. La investigación en curso tiene como objetivo esclarecer cómo estas mutaciones interrumpen el transporte axonal y identificar estrategias para restaurar la función normal. Los Institutos Nacionales de Salud y el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares están apoyando iniciativas para investigar los fundamentos moleculares de estas enfermedades y desarrollar intervenciones dirigidas.
De cara al futuro, se espera que la integración de modelos computacionales, microscopía avanzada y tecnologías de edición genómica acelere los descubrimientos en la biología de las kinesinas. Los esfuerzos colaborativos entre instituciones académicas, agencias gubernamentales y empresas biotecnológicas están fomentando la traducción de la investigación básica en aplicaciones clínicas e industriales. A medida que nuestra comprensión de las proteínas motoras kinesina se profundiza, surgirán nuevas oportunidades para manipular el transporte intracelular, diagnosticar enfermedades y diseñar estrategias terapéuticas innovadoras.
Fuentes y Referencias
- Institutos Nacionales de Salud
- Grupo de Publicaciones Nature
- Laboratorio Europeo de Biología Molecular
- Fundación Nacional de Ciencias
- Organización Europea de Biología Molecular
- Instituto Nacional de Genética
- Instituto Nacional del Cáncer