Kinesiini Moottoriproteiinit: Dynaamiset Moottorit, Jotka Ohjaavat Solun Sisäistä Logistiikkaa. Ota Selville, Kuinka Nämä Molekyylikoneet Uudistavat Solujen Toimintaa ja Terveyttä.
- Johdanto Kinesiini Moottoriproteiineihin
- Molekyylirakenne ja Toimintamekanismi
- ATP-Hydrolyysi ja Energian Muuntaminen
- Kuorman Tunnistaminen ja Sitoutumisspesifisyys
- Solun Sisäiset Kuljetusreitit
- Kinesiinin Aktiivisuuden Säätely
- Kinesiini Neuronaalisessa Toiminnassa ja Aksonikuljetuksessa
- Vertailuanalyysi: Kinesiini vs. Dynaamiini ja Myosiini
- Kinesiiniin Liittyvät Taudit ja Hoitotavoitteet
- Uudet Tutkimusalueet ja Tulevaisuuden Suunnat
- Lähteet & Viitteet
Johdanto Kinesiini Moottoriproteiineihin
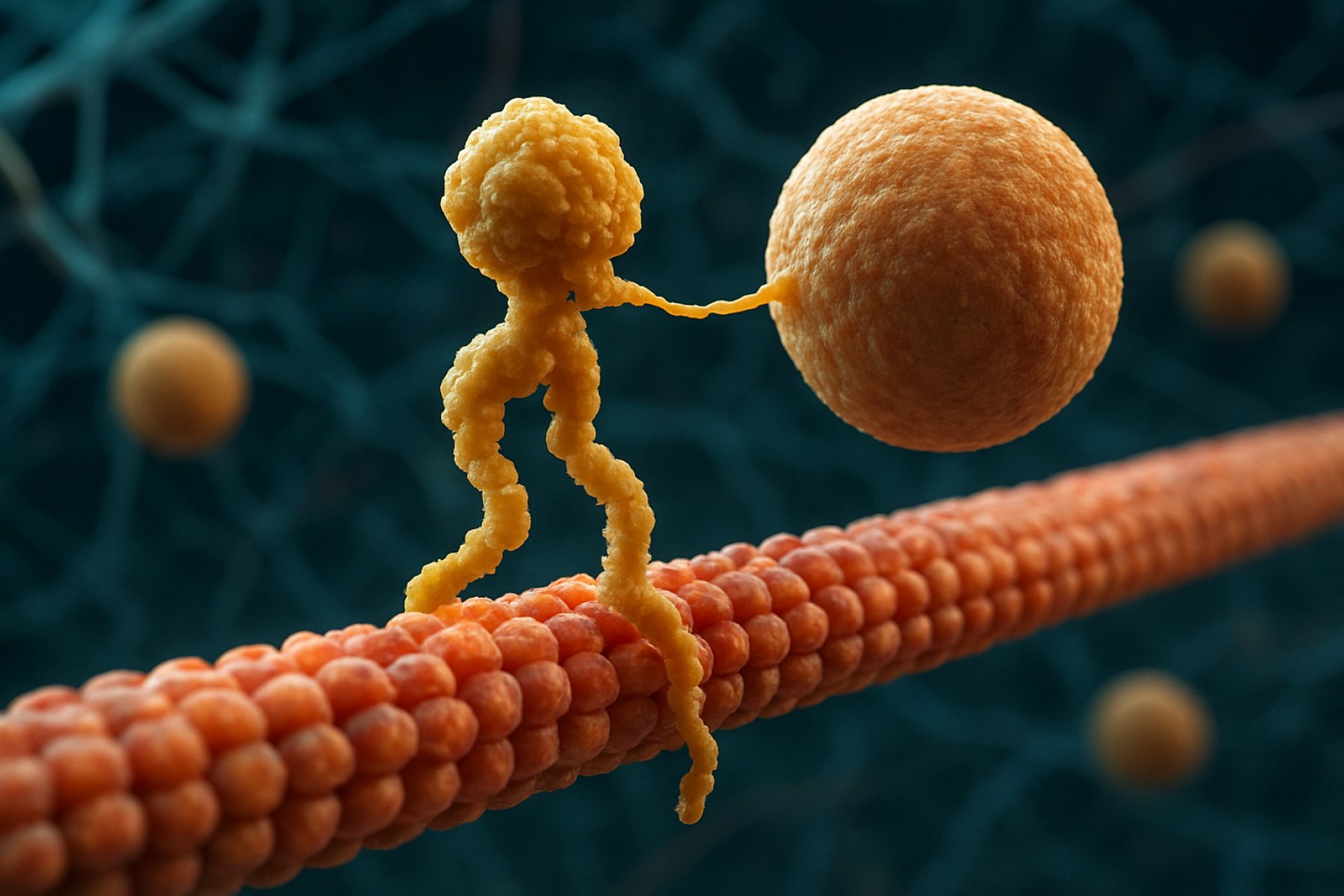
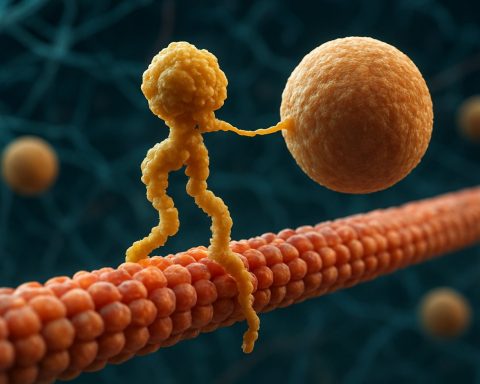
Kinesiini moottoriproteiinit ovat perusluokka molekyylimotoreita, jotka näyttelevät keskeistä roolia solun sisäisessä kuljetuksessa ja solujen organisaatiossa. Ne löydettiin 1980-luvun puolivälissä, ja kinesiinit ovat ATP-riippuvaisia proteiineja, jotka liikkuvat mikrotubuliratoja pitkin eukaryoottisissa soluissa, kuljettaen erilaisia kuormia, kuten soluelimiä, vesikkeleitä, proteiineja ja mRNA:ta. Tämä kuljetus on välttämätöntä monille soluprosesseille, mukaan lukien mitoosi, meioosi ja neuronaalinen toiminta. Kinesiini-superperhe on laaja ja monimuotoinen, sisältäen yli 40 erilaista kinesiini-geeniä ihmisissä, joista jokainen koodaa proteiineja, joilla on erikoistuneet toiminnot ja kuormaspesifisyydet.
Rakenneeltaan kinesiinit koostuvat yleensä kahdesta raskasta ketjusta ja kahdesta kevyestä ketjusta. Raskaissa ketjuissa on säilynyt moottoridomeeni, joka sitoutuu mikrotubuleihin ja hydrolysoi ATP:ta tuottaakseen liikettä. Kinesiinin häntä-domeenit vastaavat kuorman sitoutumisesta, jolloin moottori voi kuljettaa erityisiä solukomponentteja niiden tarkoitettuihin määränpäihin. Kinesiinin liike suuntautuu yleensä mikrotubulien plus-päähän, mikä yleensä vastaa solun reunoja, vaikka jotkut kinesiini-perheen jäsenet liikkuvatko miinus-päähän.
Kinesiinin liikkeen mekanismia kuvataan usein ”käsikädessä” kävelyliikuntana, jossa kaksi moottoridomeenia vuorotellen sitoutuvat ja irtoavat mikrotubulista, tehostettuna ATP:n sitoutumisen ja hydrolyysin sykleistä. Tämä prosessiivinen liike mahdollistaa kinesiinejä kulkemaan pitkiä matkoja mikrotubulien pitkin ilman irtoamista, tehden niistä erittäin tehokkaita kuljettajia tiheässä soluvälineessä. Kinesiinin aktiivisuuden tarkka säätely on ratkaisevan tärkeää soluhomeostaasin ja toiminnan ylläpitämiseksi.
Kinesiini moottoriproteiinit ovat elintärkeitä paitsi normaaleille solutoiminnoille, myös ne ovat mukana erilaisissa sairauksissa. Kinesiinin toimintahäiriöitä on liitetty neurodegeneratiivisiin sairauksiin, kuten Alzheimerin tautiin ja perinnöllisiin spastisiin paraplegioihin, sekä tiettyihin syöpiin. Tämän vuoksi kinesiinit ovat tiivistymässä tutkimuksen kohteeksi, sekä niiden perustavanlaatuista biologian ymmärtämiseksi että terapeuttisten kohteiden tutkimiseksi.
Tutkimusta kinesiini moottoriproteiineista tukevat ja edistävät johtavat tiedeorganisaatiot ja tutkimuslaitokset ympäri maailmaa, mukaan lukien National Institutes of Health ja Nature Publishing Group, jotka julkaisevat säännöllisesti vertaisarvioituja tutkimuksia näiden proteiinien rakenteesta, toiminnasta ja biolääketieteellisestä merkityksestä. Kinesiineihin liittyvän tutkimuksen jatkuva selvittäminen tuo uusia oivalluksia elämän molekulaarisista koneista ja tarjoaa lupaavia mahdollisuuksia uusien lääketieteellisten interventioiden kehittämiseen.
Molekyylirakenne ja Toimintamekanismi
Kinesiini moottoriproteiinit ovat superperhe ATP-riippuvaisia molekyylimotoreita, jotka näyttelevät keskeistä roolia solun sisäisessä kuljetuksessa, erityisesti mikrotubuliratojen varrella. Rakenteeltaan kinesiinit koostuvat yleensä kahdesta raskasta ketjusta ja kahdesta kevyestä ketjusta, muodostaen heterotetrameria kompleksin. Raskaissa ketjuissa on erittäin säilynyt N-päädynnämoottoridomeeni (myös ”pää” nimeltään), kääntökoira ja C-päädynnä häntä-domeeni. Moottoridomeeni on vastuussa sitoutumisesta mikrotubuleihin ja ATP:n hydrolysoimisesta, mikä tuottaa energian, joka tarvitaan liikkuvuuteen. Häntä-domeeni puolestaan osallistuu kuorman tunnistamiseen ja sitoutumiseen, usein vuorovaikuttaen adaptori-proteiinin tai suoraan vesikkeleiden ja soluelinten kanssa.
Kinesiini moottoriproteiinien toimintamekanismia kuvataan usein ”käsikädessä” kävelyliikunta. Jokaisessa kinesiini-molekyylissä on kaksi moottoridomeenia, jotka vuorotellen sitoutuvat ja irtoavat mikrotubulista, koordinoituina ATP:n sitoutumisen ja hydrolyysin avulla. Kun yksi pää sitoutuu mikrotubuliin ja hydrolysoi ATP:n, se kokee konformaatiomuutoksen, joka työntää toisen pään eteenpäin seuraavaan sitoutumiskohtaan, joka on noin 8 nanometriä etäisyydellä. Tämä prosessi toistuu, mahdollistaen kinesiinin ”kävellä” yksisuuntaisesti mikrotubulissa, yleensä kohti plus-päätä, joka on suuntautunut solun reunoille. Kahden pään koordinoitu toiminta takaa prosessiivisuuden, mikä tarkoittaa sitä, että kinesiini voi ottaa monia askelia mikrotubulilla ilman dissosiaatiota, mikä on olennaista tehokkaalle kuorman kuljetukselle pitkien matkojen varrella solussa.
Kinesiinit ovat erittäin monimuotoisia, ja ihmisistä on löydetty yli 40 erilaista kinesiini-geeniä, joista jokainen on mukautettu tiettyihin solutoimintoihin. Vaikka useimmat kinesiinit liikkuvat mikrotubulin plus-päähän, jotkut, kuten kinesiini-14 perheen jäsenet, liikkuvat kohti miinus-päätä, mikä korostaa tämän proteiiniperheen toiminnallista monipuolisuutta. Kinesiini aktiviteetti ja suuntautuminen määräytyvät hienovaraisilla eroilla moottoridomeeneissaan ja niihin liittyvissä säätelyalueissa.
Kinesiinin rakenteen ja toiminnan tutkimusta on edistetty korkearesoluutioisilla tekniikoilla, kuten röntgenkristallografialla ja kryoelektronimikroskopialla, jotka ovat paljastaneet yksityiskohtaisia oivalluksia konformaatiomuutoksista, jotka ovat niiden liikkuvuuden taustalla. Nämä havainnot ovat olleet ratkaisevassa asemassa ymmärtämään paitsi perussolu-biologiaa myös kinesiiniin liittyvien toimintahäiriöiden molekulaarista perustaa, kuten tiettyjä neurodegeneratiivisia sairauksia ja syöpiä. Johtavat tutkimusorganisaatiot, mukaan lukien National Institutes of Health ja European Molecular Biology Laboratory, tutkivat edelleen kinesiini moottoriproteiinien molekulaarisia mekanismeja, mikä korostaa niiden keskeistä merkitystä solubiologiassa.
ATP-Hydrolyysi ja Energian Muuntaminen
Kinesiini moottoriproteiinit ovat olennaisia molekyylikoneita, jotka muuntavat kemiallista energiaa mekaaniseksi työksi, mahdollistaen erilaisten solukerrosten kuljetuksen mikrotubulien varrella. Tämän liikkeen taustalla oleva perustavanlaatuinen prosessi on adenosiinitrifosfaatin (ATP) hydrolyysi, joka tuottaa energian, joka vaaditaan kinesiinin konformaatiomuunnoksiin ja suuntautuneeseen liikkuvuuteen.
ATP-hydrolyysi tapahtuu kinesiinin dimeraalisten moottoridomeenien (myös ”päiden”) alueilla. Jokaisessa päässä on erittäin säilynyt nukleotidiin sitoutuva alue, joka vuorotellen sitoutuu ja hydrolysoi ATP:n. Mekanokemiallinen sykli alkaa, kun yksi kinesiini pää, tiukasti sitoutuneena mikrotubuliin, sitoutuu ATP:hen. Tämä sitoutuminen saa aikaan konformaatiomuutoksen kaula-linkkerin alueella, joka työntää jäljessä olevan pään eteenpäin ”käsikädessä” -liikkeenä. Kun johtava pää sitoutuu seuraavaan tubuliinialkuun, ATP hydrolysoituu adenosiinidi- ja epäorgaaniseksi fosfaatiksi (Pi), vapauttaen energiaa, joka muuntuu mekaaniseksi liikkeeksi. Pi:n vapautuminen ja seuraava ADP:n vaihto ATP:hen palauttavat sykliin, mahdollistaen jatkuvan prosessiivisen liikkuvuuden mikrotubulissa.
Energian muuntamisen tehokkuus kinesiinin osalta on huomattavaa. Jokainen hydrolysoitu ATP-molekyyli johtaa 8-nanometrin askeleeseen mikrotubulissa, vähäisellä energiankulutuksella. Tämä korkea tehokkuus johtuu ATP-hydrolyysin ja mekaanisen askellusmekanismin tiukasta yhdistämisestä. Prosessi on tarkasti säännelty, varmistaen, että ATP-hydrolyysi tapahtuu vain, kun kinesiinin pää on oikeassa yhteydessä mikrotubuliin, estäen siten turhaa energiankulutusta.
Kinesiinin ATPaasiaktiivisuus on myös säädelty kuorman ja käytettävän kinesiini-perheen jäsenen mukaan. Esimerkiksi tavanomainen kinesiini-1 on erittäin prosessiivinen, pystyvät ottamaan satoja askeleita irtoamatta mikrotubulista, kun taas muut kinesiini-perheen jäsenet saattavat omaavat erilaisia ATP-hydrolyysiasteita ja askelluskäyttäytymistä, mukautettuna solutoimintoihinsa.
ATP-hydrolyysin ja energian muuntamisen tutkimus kinesiineissä on ollut keskeistä solujen kuljetusmekanismien ymmärtämisessä ja laajemmissa molekyylimoottoritoiminnan periaatteissa. Tämä alue on saanut tukea johtavilta tiedeorganisaatioilta, kuten National Institutes of Health ja National Science Foundation, jotka rahoittavat tutkimuksia moottoriproteiinien rakenteellisesta biologiasta ja biofyysikasta. Näistä tutkimuksista saadut oivallukset vaikuttavat neurobiologiaan, solun jakautumiseen ja nanoteknologisten sovellusten kehittämiseen, jotka jäljittelevät biologisia moottoreita.
Kuorman Tunnistaminen ja Sitoutumisspesifisyys
Kinesiini moottoriproteiinit ovat olennaisia molekyylikoneita, jotka kuljettavat laaja-alaisia solukomponentteja mikrotubuliratojen varrella, näytellen keskeistä roolia prosesseissa, kuten soluelinten positioimisessa, vesikkeli-kuljetuksessa ja mitoosissa. Se spesifisyys, jolla kinesiinit tunnistavat ja sitoutuvat kuormiin, on olennaista solun sisäisen kuljetuksen tarkkuuden ja säätelyn kannalta. Tämä spesifisyys saavutetaan yhdistämällä rakenteellisia piirteitä, adapteriproteiineja ja säätelymekanismeja.
Kinesiini-superperheelle on ominaista säilynyt moottoridomeeni, joka on vastuussa ATP-hydrolyysistä ja mikrotubulien sitoutumisesta, mutta kuorman tunnistamis- ja sitoutumistoiminnot toteutuvat pääasiassa vaihtelevaan häntä-domeenin kautta. Nämä häntä-alueet eroavat merkittävästi kinesiinin perheen jäsenistä, mahdollistaen valikoivan vuorovaikutuksen erilaisten kuormien kanssa. Esimerkiksi kinesiini-1 (tunnetaan myös tavanomaisena kinesiiniina) käyttää C-terminaalista häntää sitoutuakseen erilaisiin kuormiin, mukaan lukien kalvobiologiset soluelimet ja vesikkelit, usein adapteriproteiinien, kuten kinesiinin kevyiden ketjujen (KLC) kautta. KLC:t sisältävät tetratrikooppimotiviikkimotifit (TPR), jotka helpottavat erityisten kuorma-assosioituneiden proteiinien tunnistamista, mikä tuo tarkkuutta kuljetusprosessiin.
Adapteriproteiineilla on keskeinen rooli kinesiinin ja niiden kuormien yhdistämisessä. Nämä adapterit voivat tunnistaa erityisiä signaaleja tai motiiveja kuormapinnalla, varmistaen, että vain sopivat kuormat kuljetetaan tietyllä kinesiiniillä. Esimerkiksi KLC- ja JIP (c-Jun N-terminal kinase -vuorovaikutusproteiini) perheen jäsenten välinen vuorovaikutus on hyvin dokumentoitu neuronaalisessa kuljetuksessa, jossa JIP:t toimivat tukirakenteina yhdistäen kinesiini-1 vesikkeliin, joka sisältää signaalimolekyylejä. Muita kinesiinejä, kuten kinesiini-3, käyttävät erilaisia adaptereita ja häntä-domeenirakenteita saavuttaakseen kuormaspesifisyyden, mikä heijastaa kinesiiniin liittyvien kuormien ja solukontekstien monimuotoisuutta.
Kuorman sitoutumisen säätely saavutetaan myös post-translationalisilla modifikaatioilla ja kilpailullisilla vuorovaikutuksilla. Kinesiinin häntien tai adapteriproteiinien fosforylaatio voi muuttaa sitoutumisaffiniteettiä, mahdollistaen dynaamisen hallinnan kuormasitoamien ja vapauttamisen aikana solusignaalien mukaisesti. Lisäksi jotkin kuormat voivat kilpailla sitoutumisesta samaan kinesiiniin, tuoden lisää säätelykerroksia, jotka varmistavat oikean kuorman jakautumisen.
Tutkimus kuorman tunnistamisesta ja sitoutumisspesifisyydestä kinesiini moottoriproteiineissa on nopeasti kehittyvää, ja sillä on vaikutuksensa neurodegeneratiivisten sairauksien, solun sisäisten kuljetushäiriöiden ymmärtämiseen ja tavoitteellisten terapeuttisten kehityksiin. Johtavat tutkimusorganisaatiot, kuten National Institutes of Health ja European Molecular Biology Organization, tukevat käynnissä olevia tutkimuksia kinesiinin ja kuormien vuorovaikutusten molekulaaristen mekanismien selvittämiseksi, mikä korostaa tämän alueen biolääketieteellistä merkitystä.
Solun Sisäiset Kuljetusreitit
Kinesiini moottoriproteiinit ovat olennaisia molekyylikoneita, jotka ohjaavat solun sisäistä kuljetusta mikrotubuliratojen varrella, varmistaen tarkka toimitus soluelimiä, vesikkeleitä, proteiineja ja muita kuormia eukaryoottisissa soluissa. Nämä ATP-riippuvaiset moottorit erottuvat kyvystään muuntaa kemiallista energiaa mekaaniseksi työksi, helpottaen solukomponenttien liikuttamista pitkiä matkoja hämmästyttävällä suuntautuvuudella ja tarkkuudella.
Rakenteeltaan kinesiinit koostuvat tyypillisesti kahdesta raskasta ketjusta, jotka muodostavat dimerin, joista jokaisella on globulaarinen moottoridomeeni (pää), joka sitoutuu mikrotubuleihin ja hydrolysoi ATP:n. Häntä-domeenit vastaavat kuorman tunnistamisesta ja sitoutumisesta, useimmiten yhteistyössä kevyiden ketjujen tai adapteriproteiinien kanssa. Paras tunnettu jäsen, kinesiini-1, liikkuu pääasiassa mikrotubulien plus-päähän, mikä yleisesti vastaa solun reunoja, ja siten sillä on olennainen rooli anterogradisessa kuljetuksessa.
Kinesiinin liikkeen mekanismia kuvataan usein ”käsikädessä” kävelyliikuntana, jossa kaksi moottoridomeenia vuorotellen sitoutuvat ja askeltavat mikrotubulin rakenteessa. Jokainen askel on tiiviisti sitoutunut yksittäisen ATP-molekyylin hydrolyysiin, mikä takaa prosessiivisuuden ja suuntaavuuden. Tämä koordinoitu liike mahdollistaa kinesiinin kuljettavan kuormia matkoja, jotka voivat ulottua koko aksoniin tai muihin suuriin solutyyppeihin.
Kinesiinit luokitellaan useisiin perheisiin sekvenssihomologian ja toiminnallisen erikoistumisen mukaan. Vaikka kinesiini-1 on ensisijaisesti mukana soluelinten ja vesikkeleiden kuljetuksessa, muut perheet, kuten kinesiini-2 ja kinesiini-3, omaavat erityiset tehtävät siliary kuljetuksessa ja synaptisten vesikkeleiden kuljetuksessa. Jotkut kinesiinit, kuten kinesiini-5, ovat mukana mitoottisessa sukkularakenteessa sen sijaan, että ne keskittyisivät kuormien kuljetukseen, korostaen tämän proteiiniperheen toiminnallista monipuolisuutta.
Kinesiini moottorien aktiviteetti on tiukasti säännelty solun signaalipolkujen, post-translationalisten modifikaatioiden ja vuorovaikutusten avulla mikrotubulien assosioituneiden proteiinien kanssa. Tämä säätely varmistaa, että kuormia toimitetaan oikeisiin solusijainteihin fysiologisten tarpeiden mukaisesti. Kinesiinin välittämät kuljetukset ovat liittyneet erilaisiin sairauksiin, mukaan lukien neurodegeneratiiviset häiriöt, joissa virheellinen aksonitransportti osallistuu neuronaaliseen toimintahäiriöön ja degeneraatiota.
Tutkimus kinesiini moottoriproteiineista jatkaa solun logistiikan ymmärtämistä ja on inspiroinut biomimeettisten nanolaitteiden kehitystä. Johtavat tieteelliset organisaatiot, kuten National Institutes of Health ja Nature Publishing Group, julkaisevat säännöllisesti perusta tutkimuksia ja katsauksia kinesiini moottoreiden rakenteesta, toiminnasta ja biolääketieteellisestä merkityksestä, korostaen niiden keskeistä merkitystä solubiologiassa.
Kinesiinin Aktiivisuuden Säätely
Kinesiini moottoriproteiinit ovat olennaisia molekyylikoneita, jotka kuljettavat kuormia mikrotubulien varrella eukaryoottisissa soluissa. Kinesiinin aktiivisuuden säätely on kriittistä solujen järjestyksen ylläpitämiseksi, varmistaen oikean soluelinten jakautumisen ja tueen prosesseja, kuten mitoosi ja neuronaalinen toiminta. Useita säätelykerroksia on olemassa kontrolloimaan, milloin, missä ja miten kinesiinit vuorovaikuttavat kuormiensa ja mikrotubuliratojen kanssa.
Yksi pääasiallisista säätelymekanismeista on autoinhibiointi. Monet kinesiini perheen jäsenet, kuten kinesiini-1, omaavat häntä-domeeneja, jotka voivat taivuttaa takaisin ja vuorovaikuttaa moottoridomeeninsa kanssa, estäen ATP:aasiaktiivisuuden ja mikrotubuliin sitoutumisen kuorman puuttuessa. Tämä autoinhiboitunut konformaatio vapautuu kuorman sitoutuessa, mikä aiheuttaa konformaatiomuutoksen, joka aktivoi moottorin prosessiivista liikkuvuutta varten. Tämä mekanismi varmistaa, että kinesiinit ovat aktiivisia vain tarvittaessa, estäen turhaan ATP:n kulutusta ja mahdollista soluvahinkoa.
Post-translationaliset modifikaatiot (PTM) ovat myös merkittävässä roolissa kinesiinin aktiivisuuden säätelemisessä. Fosforylaatio on laajimmin tutkittu PTM, jossa kinasit, kuten sykliseen riippuvat kinasit (CDK) ja glykogeenisyntaasikinaasi 3 (GSK3), fosforyloivat tiettyjä jäämiä kinesiini-proteiineissa. Nämä modifikaatiot voivat joko parantaa tai estää moottoritoimintaa, kontekstista riippuen ja tietyntyyppisistä kinesiineistä. Esimerkiksi kinesiini-1:n fosforylaatio GSK3:n avulla estää sen kyvyn sitoutua mikrotubuliin, säädellen siten aksonakuljetusta neuroneissa.
Kuormaan liittyvät adapteriproteiinit tarkentavat edelleen kinesiinin säätelyä. Nämä adapterit, kuten JIP1 ja Milton, yhdistävät kinesiinit erityisiin kuormiin ja voivat muokata moottoritoimintaa stabiloimalla aktiivisen konformaation tai rekrytoimalla lisäsäätelytekijöitä. Adaptereiden ja moottoreiden välinen vuorovaikutus mahdollistaa tarkkaa paikallista ja ajallista hallintaa kuorman jakelussa, mikä on erityisen kriittistä voimakkaasti polarisoiduissa soluissa, kuten neuroneissa.
Lisäksi mikrotubuliradat voivat vaikuttaa kinesiinin aktiivisuuteen. Mikrotubuliin assosioituneet proteiinit (MAP) ja tubuliinin post-translationaliset modifikaatiot (esimerkiksi asetylaatio tai detyrosinaatio) voivat muuttaa kinesiinin sitoutumisaffiniteettia ja liikkuvuutta, ohjaten tai rajoittaen niiden liikettä tietyissä mikrotubulivalikoissa.
Kinesiini moottoriproteiinien säätely on jatkuvan tutkimuksen kohteena, ja sillä on merkitystä neurodegeneratiivisten sairauksien, syövän ja kehityshäiriöiden ymmärtämisessä. Johtavat organisaatiot, kuten National Institutes of Health ja Nature Publishing Group tukevat ja levittävät tietoa tästä alasta, mikä korostaa kinesiinin säätelyn merkitystä terveydessä ja taudeissa.
Kinesiini Neuronaalisessa Toiminnassa ja Aksonikuljetuksessa
Kinesiini moottoriproteiinit ovat ATP-riippuvainen molekyylimoottoriperhe, joka näyttelee keskeistä roolia solujen sisäisessä kuljetuksessa, erityisesti hermosolujen erittäin polarisoidussa ympäristössä. Nämä proteiinit liikkuvat mikrotubuliratojen varrella muuttaen kemiallista energiaa ATP:n hydrolyysistä mekaaniseksi työksi, mikä mahdollistaa erilaisten solukuormien ohjatun liikuttamisen. Neuroneissa kinesiinit ovat välttämättömiä soluelinten, synaptisten vesikkeleiden esimuotojen, proteiinien ja mRNA:n kuljetukselle solukehykseltä (soma) aksonin päähän, prosessi tunnetaan anterogradisen aksonikuljetuksena.
Kinesiini superperhe on monimuotoinen, ja ihmisistä on löydetty yli 40 erilaista kinesiini-geeniä, joista jokainen koodaa erikoistuneita toimintoja ja kuormaspesifisyyksiä. Parhaiten tunnettu jäsen, kinesiini-1 (myös tunnetaan tavanomaisena kinesiini) on heterotetrameri, joka koostuu kahdesta raskasta ja kahdesta kevyestä ketjusta. Raskaissa ketjuissa on moottoridomeenit, jotka ovat vastuussa ATP:n hydrolyysistä ja mikrotubuliin sitoutumisesta, kun taas kevyet ketjut vuorovaikuttavat kuorman tunnistamisen ja sitoutumisen kanssa. Tämä rakenteellinen järjestely mahdollistaa kinesiini-1:n kuljettavan laajan valikoiman kuormia, jotka ovat kriittisiä neuronaaliselle toiminnalle ja eloonjäämiselle.
Aksonikuljetus on elintärkeää neuronaalisen terveyden ja toiminnan ylläpitämiseksi, ottaen huomioon joidenkin aksonien äärimmäinen pituus, joka voi ulottua jopa metriin ihmisissä. Kinesiinin ohjaama anterogradinen kuljetus varmistaa synaptisten komponenttien, mitokondrioiden ja muiden tärkeiden soluelinten oikea-aikaisen toimituksen hermosolun kaukaisiin osiin. Kinesiinin toimintahäiriö voi johtaa synaptisen välityksen puutteellisuuteen, aksonin rappeutumiseen ja se on liitetty useisiin neurodegeneratiivisiin sairauksiin, kuten Alzheimerin tautiin ja amyotrofiseen lateraaliskleroosiin (ALS). Kinesiinin osallistumisen tärkeys neuronaaliseen terveyteen on korostettu johtavien tieteellisten organisaatioiden, kuten National Institutes of Health ja National Institute of Neurological Disorders and Stroke, tutkimuksissa, jotka ovat tuoneet esiin aksonikuljetuksen häiriöiden ja neurodegeneraation yhteyksiä.
Anterogradisen kuljetuksen lisäksi kinesiinit koordinoivat myös dynaaminen moottoriproteiinien, jotka välittävät retrogradista kuljetusta (aksonin päästä soma), jotta säilytetään kaksisuuntainen materiaalien virtaus, joka on välttämätöntä neuronaalisen homeostaasin ylläpitämiseksi. Kinesiinin aktiivisuuden, kuormavalinnan ja koordinoinnin muiden moottoriproteiinien kanssa tarkka säätely on jatkuvan tutkimuksen aiheena, jolla on merkitystä ymmärtämisessä molekulaariset perusteet neuronaaliselle yhteydelle, plastisiteetille ja taudille.
Vertailuanalyysi: Kinesiini vs. Dynaamiini ja Myosiini
Kinesiini moottoriproteiinit ovat perusluokka molekyylimoottoreita, jotka näyttelevät keskeistä roolia solun sisäisessä kuljetuksessa, erityisesti mikrotubuliratojen varrella. Ottaaksesi täysimääräisesti huomioon niiden biologisen merkityksen, on olennaista verrata kinesiinejä kahteen muuhun tärkeään säikeisten moottoriproteiiniperheeseen: dynaamiineihin ja myosiineihin. Kukin näistä moottoriproteiineista on erikoistunut liikkumiseen erityisten säikeiden varrella ja mukautettu tiettyihin solutoimintoihin.
Kinesiinit ja dynaamiinit liikkuvat molemmat mikrotubulien varrella, mutta ne eroavat suuntautumisessaan ja kuormaspesifisyydessään. Kinesiinit liikkuvat yleensä kohti mikrotubulien plus-päätä, joka tyypillisesti on suuntautunut solun reunoille, helpottaen soluelinten, vesikkeleiden ja proteiinikompleksien anterogradista kuljetusta. Dynaamiinit liikkuvat kohti mikrotubulien miinus-päätä, ohjaten kuormia kohti solun keskikohtaa, kuten tuman tai mikrotubulien järjestäytymiskeskusta. Tämä kaksisuuntainen järjestelmä varmistaa solukomponenttien tehokkaan jakautumisen ja kierrätyksen. Rakenteellisesti kinesiinit ovat tyypillisesti homodimeerisiä tai heterodimeerisiä proteiineja, joissa on kaksi moottoridomeenia, kun taas sytoplasmakinesiinit ovat suuria, moniyksiköllisiä komplekseja, joilla on monimutkaisempi voiman tuotannon ja säätelyn mekanismi (National Institute of Genetics).
Myosiinit ovat puolestaan pääasiassa aktiinipohjaisia moottoriproteiineja. Ne tunnetaan parhaiten roolistaan lihasten supistuksessa, mutta ne osallistuvat myös moniin muihin ei-lihaskuteen soluprosesseihin, kuten sytokineesiin, vesikkelikuljetukseen ja solun liikkuvuuteen. Toisin kuin kinesiinit ja dynaamiinit, jotka liikkuvat mikrotubulien varrella, myosiinit liikkuvat aktiinifilamenttien varrella, yleensä kohti plus-päätä (tupaa). Myosiinien rakenteellinen järjestely on ainutlaatuinen, ja sisältää tyypillisen pään, joka sitoutuu aktiinikuituun ja hydrolysoi ATP:tä, kaulan ja hännän, joka määrittää kuormaspesifiyys (National Institutes of Health).
Toiminnallisesti kolmas moottoriproteiiniperhe on mukautettu heidän vastaaviin säikeisiinsä ja solullisiin rooleihinsa. Kinesiinit ovat elintärkeitä pitkän matkan, suuntautuneen kuljetuksen kannalta neuroneissa ja jakautuvissa soluissa, kun taas dynaamiinit ovat tärkeitä retrogradisessa kuljetuksessa ja siliary/flaijallisen liikkeen ylläpitämisessä. Myosiinit puolestaan ovat keskiössä prosesseissa, jotka vaativat voiman generointia ja lyhyen matkan kuljetuksia aktiiniverkoissa. Näiden moottoreiden välinen vuorovaikutus varmistaa eukaryoottisten solujen dynaamisen organisaation ja sopeutumiskyvyn.
Yhteenvetona, vaikka kinesiinit, dynaamiinit ja myosiinit jakavat perustavanlaatuisen ominaisuuden muuttaa ATP-hydrolyysistä saatua kemiallista energiaa mekaaniseksi työksi, ne ovat erikoistuneet erilaisiin ratoihin, suuntiin ja solutoimintoihin. Niiden koordinoitu toiminta on välttämätöntä solurakenteen, signaloimisen ja homeostaasin ylläpitämisessä.
Kinesiiniin Liittyvät Taudit ja Hoitotavoitteet
Kinesiini moottoriproteiinit ovat olennaisia molekyylikoneita, jotka kuljettavat erilaisia solukuormia mikrotubulien varrella, näytellen keskeistä roolia solun sisäisessä kuljetuksessa, mitoosissa ja neuronaalisessa toiminnassa. Kinesiini-geenien säätelyn häiriö tai mutaatio on liitetty moniin ihmisten sairauksiin, mikä tekee näistä proteiineista merkittäviä sekä biomarkkereina että potentiaalisina terapeuttisina kohteina.
Yksi hyvin dokumentoiduista sairausassosiaatioista liittyy kinesiinin perheen jäsenen KIF1A:n. KIF1A-geenin mutaatiot ovat yhteydessä neurodegeneratiivisiin häiriöihin, którzy on kollektiivisesti nimetty KIF1A-yhteydessä oleviksi neurologisiksi häiriöiksi (KAND). Nämä tilat ilmenevät älyllisistä häiriöistä, spastisista paraplegioista ja edistyneestä neurodegeneraatiosta. Tausta patologiaa selitetään usein heikentyneellä aksonikuljetuksella, joka häiritsee synaptista toimintaa ja neuronaalista eloonjäämistä. Samoin muiden kinesiini-geenien, kuten KIF5A ja KIF21A, mutaatiot liittyvät perinnölliseen spastiseen paraplegiaan ja syntymäviin ulkoisten lihaskudosten fibroosiin, mikä edelleen korostaa kinesiinin kriittistä roolia hermoston terveydessä.
Neurodegeneroinnin lisäksi kinesiini moottoriproteiinit liittyvät myös syöpiin. Esimerkiksi KIF11 (tunnetaan myös nimellä Eg5) on välttämätön mitoottisen sukkularakenteen muodostamisessa solun jakautuessa. KIF11:n liiallinen ilmaantuminen tai hyperaktiivisuus on havaittu useissa syövissä, kuten rinta- ja eturauhassyövässä, jossa se edistää hallitsematonta solujen lisääntymistä. Tämän seurauksena KIF11:stä on noussut lupaava kohde anti-mitoottisille syöpälääkkeille. Useita pieniä molekyylin estäjä KIF11, kuten ispinesib, on tullut kliinisiin kokeisiin, joiden tarkoituksena on selektiivisesti keskeyttää syöpäsolujen jakautumista normaalisolujen säästämiseksi. Näiden estäjien kehittäminen ja arviointi ovat tiiviisti valvottuja säännöksillä ja tutkimusorganisaatioilla, kuten National Cancer Institute ja Yhdysvaltain elintarvike- ja lääkevirasto.
Terapeuttiset strategiat, jotka kohdistavat kinesiini moottoriproteiineja, ulottuvat syövän ylittäville alueille. Neurodegeneratiivisissa sairauksissa on meneillään pyrkimyksiä kehittää molekyylejä, jotka voivat palauttaa tai muuttaa kinesiinin toimintaa, toivottavasti parantaen aksonitransportin häiriöitä. Lisäksi tutkimukset, joita tukevat organisaatiot, kuten National Institutes of Health, tutkivat geeniterapiaa ja pieniä molekyylejä, jotka voivat korjata tai kompensoida virheellistä kinesiini toiminteetta geneettisissä häiriöissä.
Yhteenvetona, kinesiini moottoriproteiinit ovat keskeisiä soluihmisille, ja niiden toimintahäiriöt liittyvät moniin sairauksiin, erityisesti hermostossa ja syövässä. Jatkuvat tutkimukset ja kliinisen kehityksen ponnistelut jatkavat kinesiinin tutkimista sekä biomarkkereina että terapeuttisina kohteina, ja niiden potentiaali kehittää uusia hoitoja nykyisin hankalasti hoitoisten tiloille.
Uudet Tutkimusalueet ja Tulevaisuuden Suunnat
Uusi tutkimus kinesiini moottoriproteiineista laajentaa nopeasti ymmärrystämme niiden rooleista soluprosesseissa ja potentiaalisista sovelluksista bioteknologiassa ja lääketieteessä. Kinesiinit ovat superperhe ATP-riippuvaisia molekyylimotoreita, jotka kuljettavat kuormia mikrotubulien varrella, näytellen olennaisia rooleja solun sisäisessä kuljetuksessa, mitoosissa ja neuronaalisessa toiminnassa. Vi最近進展した高解像度イメージングおよび単分子生物物理学は、研究者たちがこれらのものを実現することを可能にするもので、これらのものをあらかじめ見越して、将来の見通しを確保したいと思います。
Yksi lupaava suunta on kinesiinin rakenteellisen monimuotoisuuden selvittäminen ja sen vaikutukset kuormaspesifisyyteen ja säätelyyn. Rakenteelliset biologiatyökalut, kuten kryoelektronimikroskopia, ovat paljastaneet erilaisia konformaatiotiloja kinesiini-perheen jäsenistä, mikä viittaa erikoistuneisiin sopeutuksiin erilaisiin solutilanteisiin. Tämä rakenteellinen tieto ohjaa pienten molekyylien ja peptidien suunnittelua, jotka voivat muokata kinesiinin toimintaa, ja sillä saattaa olla terapeuttisia sovelluksia neurodegeneratiivisissa taudeissa ja syövässä, jossa kinesiinin poikkeava toiminta on osalistanut kinesiiniin.
Synteettinen biologia hyödyntää myös kinesiini liikkuvia moottoreita suunnitellakseen nanoskaalaisia kuljetusjärjestelmiä. Hyödyntämällä kinesiinin suuntautunutta liikettä, tutkimusryhmät kehittävät biomimeettisiä laitteita, joilla on kohdennettua lääkejakelua ja molekyyliälyä. Nämä innovaatiot voisivat mullistaa tarkkuuslääketieteet, mahdollistamalla terapeuttisten aineiden kontrolloidun kuljetuksen solujen tai kudosten sisällä.
Toinen nouseva alue on kinesiinin roolin tutkimus neuronaalisessa terveydessä ja sairauksissa. Mutaatiot kinesiini-geeneissä on yhdistetty perinnöllisiin spastisiin paraplegioihin, Charcot-Marie-Tooth-tautiin ja muihin neurodegeneratiivisiin häiriöihin. Käynnissä oleva tutkimus pyrkii selvittämään, miten nämä mutaatiot häiritsevät aksonikuljetusta ja löytämään strategioita normaalin toiminnan palauttamiseksi. National Institutes of Health ja National Institute of Neurological Disorders and Stroke tukevat aloitteita tutkia näiden sairauksien molekulaarisia periaatteita ja kehittää kohdistettuja interventioita.
Tulevaisuudessa laskennallisten mallinnusten, kehittyneiden mikroskopia- ja genomiin perustuvien muokkausteknologioiden yhdistäminen on odotettavissa, mikä nopeuttaa löytöjä kinesiini-biologiassa. Yhteistyö akateemisten instituutioiden, hallitusten virastojen ja bioteknologian yritysten keskuudessa tukee perus tutkimuksen kääntämistä kliinisiin ja teollisiin sovelluksiin. Kun ymmärryksemme kinesiini moottoriproteiineista syvenee, uusia mahdollisuuksia syntyy sisäisen kuljetuksen manipuloimiseen, taudin diagnosointiin ja innovatiivisten terapeuttisten strategioiden suunnittelemiseen.
Lähteet & Viitteet
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute