Protéines Motrices Kinesin : Les Moteurs Dynamiques Qui Pilotent la Logistique Intracellulaire. Découvrez Comment Ces Machines Moléculaires Révolutionnent la Fonction Cellulaire et la Santé.
- Introduction aux Protéines Motrices Kinesin
- Structure Moléculaire et Mécanisme d’Action
- Hydrolyse de l’ATP et Conversion d’Énergie
- Reconnaissance des Charges et Spécificité de Liaison
- Voies de Transport Intracellulaire
- Régulation de l’Activité des Kinesins
- Kinesin dans la Fonction Neuronale et le Transport Axonal
- Analyse Comparative : Kinesin vs. Dynein et Myosine
- Maladies Liées aux Kinesins et Cibles Thérapeutiques
- Recherche Émergente et Directions Futures
- Sources & Références
Introduction aux Protéines Motrices Kinesin
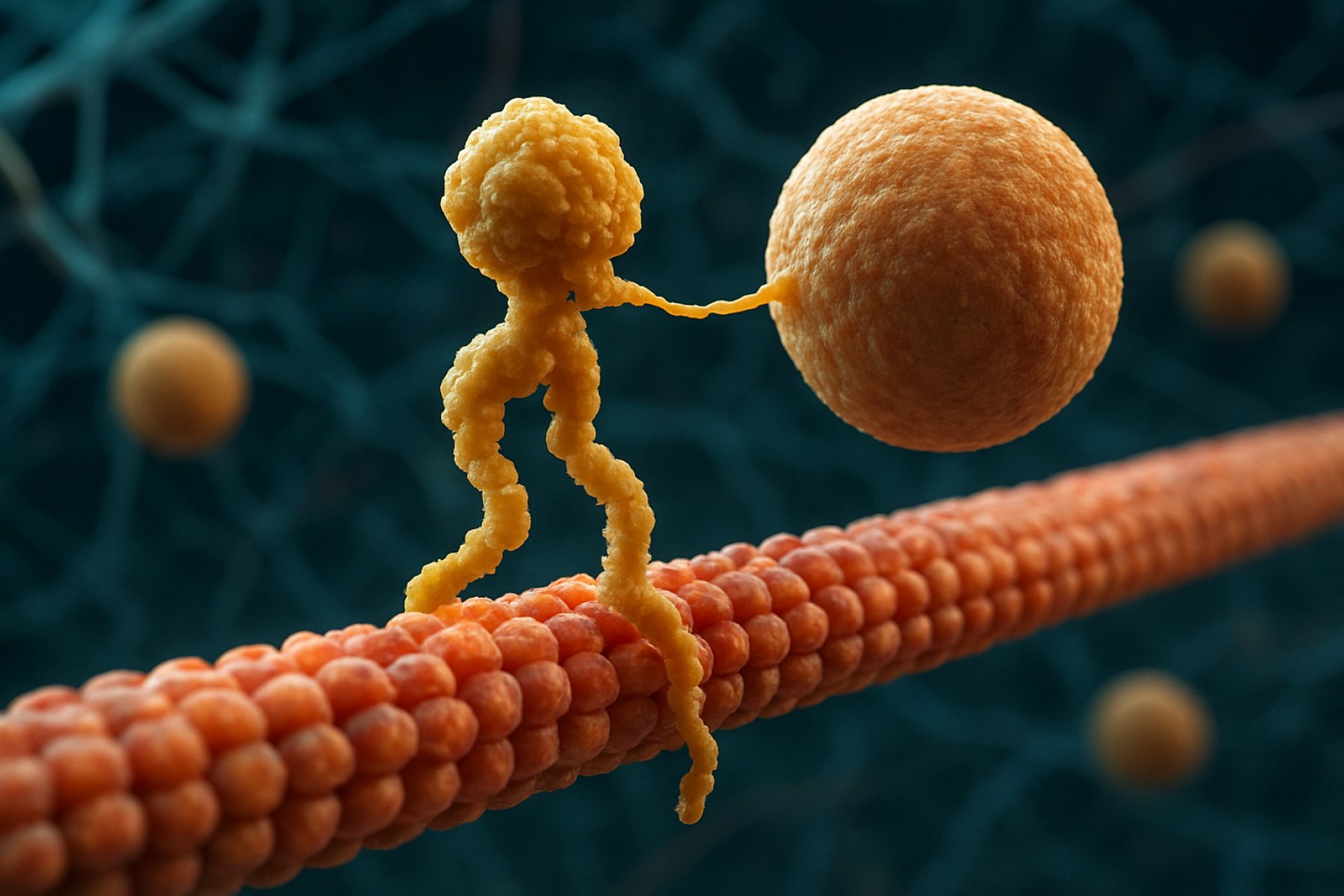
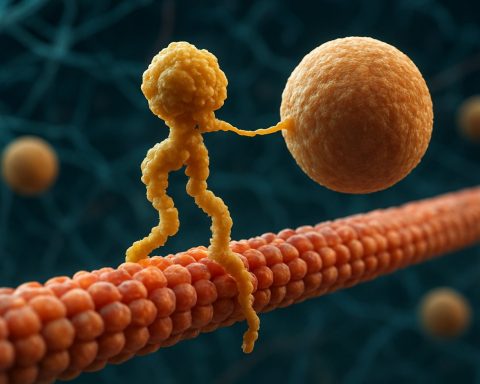
Les protéines motrices kinesin constituent une classe fondamentale de moteurs moléculaires jouant un rôle crucial dans le transport intracellulaire et l’organisation cellulaire. Découvertes au milieu des années 1980, les kinesins sont des protéines dépendantes de l’ATP qui se déplacent le long des microtubules dans les cellules eucaryotes, transportant une variété de charges telles que des organites, des vésicules, des protéines et de l’ARNm. Ce transport est essentiel pour de nombreux processus cellulaires, y compris la mitose, la méiose et la fonction neuronale. La superfamille des kinesins est grande et diverse, avec plus de 40 gènes de kinesin identifiés chez l’homme, chacun codant pour des protéines aux fonctions et spécificités de charge spécialisées.
Structuellement, les kinesins sont généralement composés de deux chaînes lourdes et de deux chaînes légères. Les chaînes lourdes contiennent un domaine moteur conservé, qui se lie aux microtubules et hydrolyse l’ATP pour générer le mouvement. Les domaines de queue des kinesins sont responsables de la liaison à la charge, permettant au moteur de transporter des composants cellulaires spécifiques vers leurs destinations prévues. Le mouvement des kinesins est généralement dirigé vers l’extrémité positive des microtubules, ce qui correspond généralement à la périphérie cellulaire, bien que certains membres de la famille des kinesins se déplacent vers l’extrémité négative.
Le mécanisme de mouvement des kinesins est souvent décrit comme une motion de marche « main par main », où les deux domaines moteurs se lient et se libèrent alternativement des microtubules, alimentés par des cycles de liaison et d’hydrolyse de l’ATP. Ce mouvement processif permet aux kinesins de parcourir de longues distances le long des microtubules sans se détacher, ce qui les rend très efficaces en tant que transporteurs dans l’environnement cellulaire encombré. La régulation précise de l’activité des kinesins est cruciale pour maintenir l’homéostasie cellulaire et la fonction.
Les protéines motrices kinesin sont non seulement vitales pour les opérations cellulaires normales, mais sont également impliquées dans diverses maladies. Les défauts dans la fonction des kinesins ont été associés à des troubles neurodégénératifs, tels que la maladie d’Alzheimer et la paraplégie spastique héréditaire, ainsi que certains cancers. En conséquence, les kinesins font l’objet de recherches intensives, tant pour comprendre leur biologie fondamentale que pour explorer leur potentiel en tant que cibles thérapeutiques.
La recherche sur les protéines motrices kinesin est soutenue et avancée par des organisations scientifiques de premier plan et des instituts de recherche dans le monde entier, incluant les National Institutes of Health et le Nature Publishing Group, qui publient régulièrement des études évaluées par les pairs sur la structure, la fonction et la signification biomédicale de ces protéines. L’étude en cours des kinesins permet de révéler de nouvelles perspectives sur la machinerie moléculaire de la vie et offre des pistes prometteuses pour le développement de nouvelles interventions médicales.
Structure Moléculaire et Mécanisme d’Action
Les protéines motrices kinesin constituent une superfamille de moteurs moléculaires dépendants de l’ATP qui jouent un rôle crucial dans le transport intracellulaire, en particulier le long des pistes de microtubules. Structuellement, les kinesins sont généralement composés de deux chaînes lourdes et de deux chaînes légères, formant un complexe hétérotétramérique. Les chaînes lourdes contiennent un domaine moteur N-terminal très conservé (également appelé « tête »), un tige enroulée en spirale, et un domaine de queue C-terminal. Le domaine moteur est responsable de la liaison aux microtubules et de l’hydrolyse de l’ATP, qui fournit l’énergie nécessaire au mouvement. Le domaine de queue, quant à lui, est impliqué dans la reconnaissance et la liaison à la charge, souvent en interagissant avec des protéines adaptatrices ou directement avec des vésicules et des organites.
Le mécanisme d’action des protéines motrices kinesin est souvent décrit comme une motion de marche « main par main ». Chaque molécule de kinesin possède deux domaines moteurs qui se lient alternativement et se libèrent du microtubule, coordonnés par la liaison et l’hydrolyse de l’ATP. Lorsque l’une des têtes se lie au microtubule et hydrolyse l’ATP, elle subit un changement de conformation qui propulse l’autre tête vers l’avant vers le prochain site de liaison, à environ 8 nanomètres de distance. Ce processus se répète, permettant au kinesin de « marcher » dans une direction le long du microtubule, généralement vers l’extrémité positive, qui est orientée vers la périphérie cellulaire. L’action coordonnée des deux têtes assure la processivité, ce qui signifie que le kinesin peut faire de nombreux pas le long d’un microtubule sans se dissocier, ce qui est essentiel pour un transport efficace des charges sur de longues distances dans la cellule.
Les kinesins sont très diversifiés, avec plus de 40 gènes de kinesins différents identifiés chez l’homme, chacun étant adapté à des fonctions cellulaires spécifiques. Bien que la plupart des kinesins se dirigent vers l’extrémité positive des microtubules, certains, comme les membres de la famille kinesin-14, se déplacent vers l’extrémité négative, soulignant la polyvalence fonctionnelle de cette famille de protéines. L’activité et la directionnalité des kinesins sont déterminées par de subtiles différences dans leurs domaines moteurs et les régions régulatrices associées.
L’étude de la structure et de la fonction des kinesins a été avancée par des techniques de haute résolution telles que la cristallographie aux rayons X et la cryo-microscopie électronique, qui ont révélé des aperçus détaillés des changements conformationnels qui sous-tendent leur motilité. Ces résultats ont été essentiels pour comprendre non seulement la biologie cellulaire fondamentale, mais aussi la base moléculaire des maladies liées à la dysfonction des kinesins, telles que certains troubles neurodégénératifs et cancers. Les principales organisations de recherche, y compris les National Institutes of Health et le European Molecular Biology Laboratory, continuent d’examiner les mécanismes moléculaires des protéines motrices kinesin, soulignant leur importance fondamentale en biologie cellulaire.
Hydrolyse de l’ATP et Conversion d’Énergie
Les protéines motrices kinesin sont des machines moléculaires essentielles qui convertissent l’énergie chimique en travail mécanique, permettant le transport de diverses charges cellulaires le long des microtubules. Le processus fondamental sous-jacent à ce mouvement est l’hydrolyse de l’adénosine triphosphate (ATP), qui fournit l’énergie nécessaire aux changements conformationnels des kinesins et à leur motilité directionnelle.
L’hydrolyse de l’ATP se produit aux domaines moteurs (également appelés « têtes ») du dimère de kinesin. Chaque tête contient un site de liaison de nucléotides hautement conservé qui lie et hydrolyse alternativement l’ATP. Le cycle mécano-chimique commence lorsqu’une tête de kinesin, étroitement liée au microtubule, lie l’ATP. Cette liaison induit un changement de conformation dans la région de liaison, propulsant la tête arrière vers l’avant dans un mouvement « main par main ». Alors que la tête avant se lie au sous-unité de tubuline suivante, l’ATP est hydrolysé en adénosine diphosphate (ADP) et phosphate inorganique (Pi), libérant de l’énergie qui est transduite en mouvement mécanique. La libération de Pi et l’échange subséquent de l’ADP contre l’ATP réinitialisent le cycle, permettant un mouvement processif continu le long du microtubule.
L’efficacité de la conversion d’énergie des kinesins est remarquable. Chaque molécule d’ATP hydrolysée résulte en un pas de 8 nanomètres le long du microtubule, avec des pertes d’énergie minimales. Cette haute efficacité est attribuée au couplage étroit entre l’hydrolyse de l’ATP et le mécanisme de pas mécanique. Le processus est hautement régulé, garantissant que l’hydrolyse de l’ATP ne se produit que lorsque la tête de kinesin est correctement engagée avec le microtubule, empêchant ainsi des dépenses d’énergie inutiles.
L’activité ATPase des kinesins est également modulée par la présence de charges et le type spécifique de membres de la famille des kinesins impliqués. Par exemple, le kinesin-1 conventionnel est très processif, capable de faire des centaines de pas sans se dissocier du microtubule, tandis que d’autres membres de la famille des kinesins peuvent avoir des taux d’hydrolyse d’ATP et des comportements de pas différents, adaptés à leurs fonctions cellulaires.
L’étude de l’hydrolyse de l’ATP et de la conversion d’énergie dans les kinesins a été essentielle pour comprendre les mécanismes de transport intracellulaire et les principes plus larges de la fonction des moteurs moléculaires. La recherche dans ce domaine est soutenue par des organisations scientifiques de premier plan telles que les National Institutes of Health et la National Science Foundation, qui financent des investigations sur la biologie structurale et la biophysique des protéines motrices. Les connaissances acquises dans ces études ont des implications pour la neurobiologie, la division cellulaire et le développement d’applications nanotechnologiques qui imitent les moteurs biologiques.
Reconnaissance des Charges et Spécificité de Liaison
Les protéines motrices kinesin sont des machines moléculaires essentielles qui transportent une large variété de charges intracellulaires le long des pistes de microtubules, jouant un rôle central dans des processus tels que le positionnement des organites, le trafic des vésicules et la mitose. La spécificité avec laquelle les kinesins reconnaissent et se lient à leur charge est fondamentale pour la fidélité et la régulation du transport intracellulaire. Cette spécificité est obtenue grâce à une combinaison de caractéristiques structurales, de protéines adaptatrices et de mécanismes régulateurs.
La superfamille des kinesins est caractérisée par un domaine moteur conservé responsable de l’hydrolyse de l’ATP et de la liaison aux microtubules, mais les fonctions de reconnaissance et de liaison aux charges sont principalement médiées par les domaines de queue variables. Ces régions de queue diffèrent considérablement entre les membres de la famille des kinesins, permettant l’interaction sélective avec des charges distinctes. Par exemple, le kinesin-1 (également connu sous le nom de kinesin conventionnel) utilise sa queue C-terminale pour se lier à une variété de charges, y compris des organites liés aux membranes et des vésicules, souvent par l’intermédiaire de protéines adaptatrices telles que les chaînes légères des kinesins (KLC). Les KLC contiennent des motifs de répétition de tétratricopeptides (TPR) qui facilitent la reconnaissance des protéines associées aux charges spécifiques, conférant ainsi une sélectivité au processus de transport.
Les protéines adaptatrices jouent un rôle crucial en reliant les kinesins à leurs charges. Ces adaptateurs peuvent reconnaître des signaux ou motifs spécifiques sur la surface de la charge, garantissant que seule la charge appropriée est transportée par un kinesin donné. Par exemple, l’interaction entre les KLC et les membres de la famille JIP (protéine d’interaction avec la kinase JNK) est bien documentée dans le transport neuronal, où les JIPs agissent comme des échafaudages liant le kinesin-1 aux vésicules contenant des molécules de signalisation. D’autres membres de la famille des kinesins, tels que le kinesin-3, utilisent différents adaptateurs et structures de domaine de queue pour obtenir une spécificité de charge, reflétant la diversité des charges et des contextes cellulaires dans lesquels les kinesins opèrent.
La régulation de la liaison aux charges est également obtenue par des modifications post-traductionnelles et des interactions compétitives. La phosphorylation des queues des kinesins ou des protéines adaptatrices peut moduler l’affinité de liaison, permettant un contrôle dynamique de l’attachement et de la libération des charges en réponse aux signaux cellulaires. De plus, certaines charges peuvent entrer en compétition pour se lier au même kinesin, introduisant une autre couche de régulation qui assure une distribution correcte des charges.
L’étude de la reconnaissance des charges et de la spécificité de liaison dans les protéines motrices kinesin est un domaine en évolution rapide, avec des implications pour comprendre les maladies neurodégénératives, les troubles de trafic intracellulaire et le développement de thérapeutiques ciblées. Les principales organisations de recherche telles que les National Institutes of Health et l’European Molecular Biology Organization soutiennent les enquêtes en cours sur les mécanismes moléculaires sous-jacents des interactions kinesin-charge, soulignant l’importance biomédicale de ce domaine.
Voies de Transport Intracellulaire
Les protéines motrices kinesin sont des machines moléculaires essentielles qui entraînent le transport intracellulaire le long des pistes de microtubules, garantissant la livraison précise d’organites, de vésicules, de protéines et d’autres charges dans les cellules eucaryotes. Ces moteurs dépendants de l’ATP sont caractérisés par leur capacité à convertir l’énergie chimique en travail mécanique, facilitant le mouvement des composants cellulaires sur de longues distances avec une directionnalité et une spécificité remarquables.
Structuellement, les kinesins se composent généralement de deux chaînes lourdes formant un dimère, chacune ayant un domaine moteur globulaire (tête) qui se lie aux microtubules et hydrolyse l’ATP. Les domaines de queue sont responsables de la reconnaissance et de la liaison à la charge, souvent en association avec des chaînes légères ou des protéines adaptatrices. Le membre le plus étudié, le kinesin-1, se déplace principalement vers l’extrémité positive des microtubules, ce qui correspond généralement à la périphérie cellulaire, jouant ainsi un rôle pivot dans le transport antérograde.
Le mécanisme de mouvement des kinesins est souvent décrit comme une motion de marche « main par main », où les deux domaines moteurs se lient et avancent alternativement le long du réseau de microtubules. Chaque pas est étroitement couplé à l’hydrolyse d’une seule molécule d’ATP, assurant la processivité et la directionnalité. Ce mouvement coordonné permet aux kinesins de transporter des charges sur des distances qui peuvent couvrir toute la longueur d’un neurone ou d’autres types de grandes cellules.
Les kinesins sont classés en plusieurs familles sur la base de l’homologie de séquence et de la spécialisation fonctionnelle. Alors que le kinesin-1 est principalement impliqué dans le transport d’organites et de vésicules, d’autres familles telles que le kinesin-2 et le kinesin-3 jouent des rôles distincts dans le transport ciliaire et le trafic des vésicules synaptiques, respectivement. Certains kinesins, comme le kinesin-5, sont impliqués dans la dynamique du fuseau mitotique plutôt que dans le transport de charges, soulignant la diversité fonctionnelle au sein de cette superfamille de protéines.
L’activité des moteurs kinesin est étroitement régulée par des voies de signalisation cellulaires, des modifications post-traductionnelles et des interactions avec des protéines associées aux microtubules. Cette régulation garantit que les charges sont livrées aux bonnes localisations subcellulaires en réponse aux besoins physiologiques. La perturbation du transport médié par les kinesins a été impliquée dans diverses maladies, notamment les troubles neurodégénératifs, où un transport axonal défectueux contribue à la dysfonction neuronale et à la dégénérescence.
La recherche sur les protéines motrices kinesin continue d’avancer notre compréhension de la logistique cellulaire et a inspiré le développement de dispositifs nanométriques biomimétiques. Des organisations scientifiques de premier plan telles que les National Institutes of Health et le Nature Publishing Group publient régulièrement des études fondamentales et des revues sur la structure, la fonction et l’importance biomédicale des moteurs kinesin, soulignant leur rôle central en biologie cellulaire.
Régulation de l’Activité des Kinesins
Les protéines motrices kinesin sont des machines moléculaires essentielles qui transportent des charges le long des microtubules dans les cellules eucaryotes. La régulation de l’activité des kinesins est cruciale pour maintenir l’organisation cellulaire, garantir la distribution appropriée des organites et soutenir des processus tels que la mitose et la fonction neuronale. Plusieurs couches de régulation existent pour contrôler quand, où et comment les kinesins interagissent avec leurs charges et les pistes de microtubules.
Un mécanisme principal de régulation se fait par autoinhibition. De nombreux membres de la famille des kinesins, tels que le kinesin-1, possèdent des domaines de queue qui peuvent se replier et interagir avec leurs domaines moteurs, empêchant l’activité ATPase et la liaison aux microtubules en l’absence de charge. Cette conformation autoinhibée est relâchée lors de la liaison à la charge, induisant un changement de conformation qui active le moteur pour un mouvement processif. Ce mécanisme garantit que les kinesins ne sont actifs que lorsque cela est nécessaire, évitant ainsi une consommation d’ATP inutile et d’éventuels dommages cellulaires.
Les modifications post-traductionnelles (PTMs) jouent également un rôle significatif dans la modulation de l’activité des kinesins. La phosphorylation est la PTM la plus étudiée, les kinases telles que les kinases dépendantes des cyclines (CDKs) et la kinase 3 de la synthèse du glycogène (GSK3) phosphorylant des résidus spécifiques sur les protéines kinesin. Ces modifications peuvent soit renforcer, soit inhiber l’activité du moteur, selon le contexte et le kinesin spécifique impliqué. Par exemple, la phosphorylation du kinesin-1 par GSK3 inhibe sa capacité à se lier aux microtubules, régulant ainsi le transport axonal dans les neurones.
Les protéines adaptatrices de charges précisent encore la régulation des kinesins. Ces adaptateurs, tels que JIP1 et Milton, lient les kinesins à des charges spécifiques et peuvent moduler l’activité du moteur en stabilisant la conformation active ou en recrutant des facteurs régulateurs supplémentaires. L’interaction entre les adaptateurs et les moteurs permet un contrôle spatial et temporel précis de la livraison des charges, ce qui est particulièrement critique dans les cellules hautement polarisées comme les neurones.
De plus, les pistes de microtubules elles-mêmes peuvent influencer l’activité des kinesins. Les protéines associées aux microtubules (MAPs) et les modifications post-traductionnelles de la tubuline (telles que l’acétylation ou la détyrosination) peuvent altérer l’affinité de liaison et la motilité des kinesins, guidant ou restreignant efficacement leur mouvement le long de sous-ensembles spécifiques de microtubules.
La régulation des protéines motrices kinesin est un sujet de recherche en cours, avec des implications pour la compréhension des maladies neurodégénératives, du cancer et des troubles du développement. Des organisations de premier plan telles que les National Institutes of Health et le Nature Publishing Group soutiennent et diffusent la recherche dans ce domaine, soulignant l’importance de la régulation des kinesins dans la santé et la maladie.
Kinesin dans la Fonction Neuronale et le Transport Axonal
Les protéines motrices kinesin forment une superfamille de moteurs moléculaires dépendants de l’ATP qui jouent un rôle essentiel dans le transport intracellulaire, notamment dans l’environnement hautement polarisé des neurones. Ces protéines se déplacent le long des pistes de microtubules, convertissant l’énergie chimique de l’hydrolyse de l’ATP en travail mécanique, ce qui permet le mouvement dirigé de diverses charges cellulaires. Dans les neurones, les kinesins sont essentiels pour le transport des organites, des précurseurs de vésicules synaptiques, des protéines et des ARNm du corps cellulaire (soma) à la terminaison axonale, un processus appelé transport axonal antérograde.
La superfamille des kinesins est diverse, avec plus de 40 gènes différents de kinesin identifiés chez l’homme, chacun codant pour des protéines ayant des fonctions spécialisées et des spécificités de charge. Le membre le plus caractérisé, le kinesin-1 (également connu sous le nom de kinesin conventionnel), est un hétérotétramère composé de deux chaînes lourdes et de deux chaînes légères. Les chaînes lourdes contiennent les domaines moteurs responsables de l’hydrolyse de l’ATP et de la liaison aux microtubules, tandis que les chaînes légères interviennent dans la reconnaissance et la liaison aux charges. Cette organisation structurelle permet au kinesin-1 de transporter une large variété de charges critiques pour la fonction neuronale et la survie.
Le transport axonal est vital pour maintenir la santé et la fonction neuronale, étant donné la longueur extrême de certains axones, qui peuvent atteindre jusqu’à un mètre chez l’homme. Le transport antérograde entraîné par les kinesins garantit la livraison en temps voulu des composants synaptiques, des mitochondries et d’autres organites essentiels aux régions distales du neurone. La perturbation de la fonction des kinesins peut entraîner des déficits dans la transmission synaptique, une dégénérescence axonale, et a été impliquée dans plusieurs maladies neurodégénératives, y compris la maladie d’Alzheimer et la sclérose latérale amyotrophique (SLA). L’importance du transport médié par les kinesins dans la santé neuronale est soulignée par les recherches d’organisations scientifiques de premier plan telles que les National Institutes of Health et l’Institut National des Troubles Neurologiques et des Accidents Vasculaires, qui ont mis en évidence le lien entre les défauts de transport axonal et la neurodégénération.
En plus du transport antérograde, les kinesins coordonnent également avec les protéines motrices dyneines, qui médiatisent le transport rétrograde (de la terminaison axonale vers le soma), pour maintenir le flux bidirectionnel des matériaux nécessaire à l’homéostasie neuronale. La régulation précise de l’activité des kinesins, de la sélection des charges et de la coordination avec d’autres protéines motrices est un sujet de recherche en cours, ayant des implications pour comprendre la base moléculaire de la connectivité neuronale, la plasticité et la maladie.
Analyse Comparative : Kinesin vs. Dynein et Myosine
Les protéines motrices kinesin constituent une classe fondamentale de moteurs moléculaires qui jouent un rôle crucial dans le transport intracellulaire, en particulier le long des pistes de microtubules. Pour apprécier pleinement leur signification biologique, il est essentiel de comparer les kinesins avec les deux autres grandes familles de protéines motrices cytosquelettiques : les dyneins et les myosines. Chacune de ces protéines motrices est spécialisée pour le mouvement le long de filaments cytosquelettiques distincts et est adaptée à des fonctions cellulaires spécifiques.
Les kinesins et les dyneins parcourent tous deux des microtubules, mais ils diffèrent par leur directionnalité et leur spécificité de charge. Les kinesins se déplacent généralement vers l’extrémité positive des microtubules, qui est typiquement orientée vers la périphérie cellulaire, facilitant le transport antérograde des organites, des vésicules et des complexes protéiques. En revanche, les dyneins se déplacent vers l’extrémité négative des microtubules, dirigeant les charges vers le centre de la cellule, comme le noyau ou le centre organisateur des microtubules. Ce système bidirectionnel garantit une distribution et un recyclage efficaces des composants cellulaires. Structuellement, les kinesins sont généralement des protéines homodimériques ou hétérodimériques avec deux domaines moteurs, tandis que les dyneins cytoplasmiques sont de grands complexes multi-sous-unités avec un mécanisme de génération de force et de régulation plus complexe (National Institute of Genetics).
Les myosines, quant à elles, sont principalement des protéines motrices basées sur l’actine. Elles sont mieux connues pour leur rôle dans la contraction musculaire, mais elles participent également à une variété de processus cellulaires non musculaires, tels que la cytokinese, le transport des vésicules et la motilité cellulaire. Contrairement aux kinesins et aux dyneins, qui se déplacent le long des microtubules, les myosines parcourent les filaments d’actine, généralement vers l’extrémité positive (barbue). L’organisation structurelle des myosines est distincte, avec un domaine de tête caractéristique qui lie l’actine et hydrolyse l’ATP, une région de cou, et une queue qui détermine la spécificité de la charge (National Institutes of Health).
Fonctionnellement, les trois familles de protéines motrices sont adaptées à leurs pistes cytosquelettiques respectives et aux rôles cellulaires. Les kinesins sont cruciaux pour le transport directionnel à longue distance dans les neurones et les cellules en division, tandis que les dyneins sont essentiels pour le transport rétrograde et les mouvements ciliaires/flaggellaires. Les myosines, en revanche, sont centrales dans les processus nécessitant la génération de force et le transport à courte distance sur les réseaux d’actine. L’interaction entre ces moteurs garantit l’organisation dynamique et l’adaptabilité de la cellule eucaryote.
En résumé, bien que les kinesins, les dyneins et les myosines partagent la propriété fondamentale de convertir l’énergie chimique de l’hydrolyse de l’ATP en travail mécanique, ils sont spécialisés pour différentes pistes, directions et fonctions cellulaires. Leurs actions coordonnées sont vitales pour maintenir l’architecture cellulaire, la signalisation et l’homéostasie.
Maladies Liées aux Kinesins et Cibles Thérapeutiques
Les protéines motrices kinesin sont des machines moléculaires essentielles qui transportent diverses charges cellulaires le long des microtubules, jouant un rôle central dans le trafic intracellulaire, la mitose et la fonction neuronale. La dérégulation ou la mutation des gènes des kinesins a été implicité dans une gamme de maladies humaines, rendant ces protéines significatives à la fois comme biomarqueurs et comme cibles thérapeutiques potentielles.
L’une des associations de maladies les plus documentées concerne le membre de la famille des kinesins KIF1A. Des mutations dans le gène KIF1A sont liées à un spectre de troubles neurodégénératifs, appelés collectivement trouble neurologique associé à KIF1A (KAND). Ces conditions se manifestent par un handicap intellectuel, une paraplégie spastique et une neurodégénérescence progressive. La pathologie sous-jacente est souvent attribuée à un transport axonal altéré, qui perturbe la fonction synaptique et la survie neuronale. De même, des mutations dans d’autres gènes de kinesins, tels que KIF5A et KIF21A, sont associées à la paraplégie spastique héréditaire et à la fibrose congénitale des muscles oculomoteurs, respectivement, soulignant encore le rôle critique des kinesins dans la santé du système nerveux.
Au-delà de la neurodégénérescence, les protéines motrices kinesin sont également impliquées dans le cancer. Par exemple, KIF11 (également connu sous le nom d’Eg5) est essentielle pour la formation du fuseau mitotique lors de la division cellulaire. Une surexpression ou une hyperactivité de KIF11 a été observée dans divers cancers, y compris le cancer du sein et de la prostate, où elle contribue à une prolifération cellulaire incontrôlée. En conséquence, KIF11 est devenue une cible prometteuse pour les thérapies anticancéreuses anti-mitotiques. Plusieurs inhibiteurs de petites molécules de KIF11, tels que l’ispinesib, ont été introduits dans des essais cliniques, visant à perturber sélectivement la division des cellules cancéreuses tout en épargnant les cellules normales. Le développement et l’évaluation de ces inhibiteurs sont étroitement surveillés par les organismes de réglementation et de recherche tels que le National Cancer Institute et la Food and Drug Administration des États-Unis.
Les stratégies thérapeutiques ciblant les protéines motrices kinesin s’étendent au-delà de l’oncologie. Dans les maladies neurodégénératives, des efforts sont en cours pour développer des molécules capables de restaurer ou de moduler la fonction des kinesins, ce qui pourrait atténuer les déficits de transport axonal. De plus, des recherches soutenues par des organisations telles que les National Institutes of Health explorent la thérapie génique et les approches à base de petites molécules pour corriger ou compenser l’activité des kinesins défectueuse dans les troubles génétiques.
En résumé, les protéines motrices kinesin sont centrales à la santé cellulaire, et leur dysfonction est liée à une variété de maladies, en particulier dans le système nerveux et dans le cancer. Les efforts de recherche en cours et de développement clinique continuent d’explorer les kinesins en tant que biomarqueurs et cibles thérapeutiques, avec le potentiel de fournir de nouveaux traitements pour des conditions actuellement intransigeantes.
Recherche Émergente et Directions Futures
La recherche émergente sur les protéines motrices kinesin élargit rapidement notre compréhension de leur rôle dans les processus cellulaires et leurs applications potentielles en biotechnologie et en médecine. Les kinesins constituent une superfamille de moteurs moléculaires dépendants de l’ATP qui transportent des charges le long des microtubules, jouant des rôles essentiels dans le trafic intracellulaire, la mitose et la fonction neuronale. Les avancées récentes en imagerie de haute résolution et en biophysique des molécules uniques ont permis aux chercheurs de visualiser la dynamique des kinesins dans des détails sans précédent, révélant de nouvelles perspectives sur leurs cycles mécano-chimiques et leurs mécanismes régulateurs.
Une direction prometteuse implique l’élucidation de la diversité structurelle des kinesins et de ses implications pour la spécificité et la régulation des charges. Les techniques de biologie structurale, telles que la cryo-microscopie électronique, ont révélé des états conformationnels distincts des membres de la famille des kinesins, suggérant des adaptations spécialisées pour différentes tâches cellulaires. Ces connaissances structurelles informent la conception de petites molécules et de peptides capables de moduler l’activité des kinesins, avec des applications thérapeutiques potentielles dans les maladies neurodégénératives et le cancer, où une fonction anormale des kinesins est impliquée dans la pathogénèse.
La biologie synthétique exploite également les moteurs kinesin pour concevoir des systèmes de transport à l’échelle nanométrique. En utilisant le mouvement directionnel des kinesins, les chercheurs développent des dispositifs biomimétiques pour la livraison ciblée de médicaments et l’assemblage moléculaire. Ces innovations pourraient révolutionner la médecine de précision en permettant le transport contrôlé d’agents thérapeutiques à l’intérieur des cellules ou des tissus.
Un autre domaine émergent est l’étude du rôle des kinesins dans la santé et la maladie neuronale. Des mutations dans les gènes des kinesins ont été liées à la paraplégie spastique héréditaire, à la maladie de Charcot-Marie-Tooth et à d’autres troubles neurodégénératifs. La recherche en cours vise à clarifier comment ces mutations perturbent le transport axonal et à identifier des stratégies pour restaurer la fonction normale. Les National Institutes of Health et l’Institut National des Troubles Neurologiques et des Accidents Vasculaires soutiennent des initiatives visant à examiner les bases moléculaires de ces maladies et à développer des interventions ciblées.
En perspective, l’intégration de la modélisation informatique, de la microscopie avancée et des technologies d’édition du génome devrait accélérer les découvertes dans la biologie des kinesins. Les efforts collaboratifs entre les institutions académiques, les agences gouvernementales et les entreprises de biotechnologie favorisent la translation de la recherche fondamentale vers des applications cliniques et industrielles. À mesure que notre compréhension des protéines motrices kinesin s’approfondit, de nouvelles opportunités surgiront pour manipuler le transport intracellulaire, diagnostiquer des maladies et concevoir des stratégies thérapeutiques innovantes.
Sources & Références
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute