חלבוני המנוע קינזין: המנועים הדינמיים המניעים את הלוגיסטיקה התוך-תאית. גלו כיצד מכונות מולקולריות אלו מהפכות את תפקוד התא והבריאות.
- הקדמה לחלבוני המנוע קינזין
- מבנה מולקולרי ומנגנון פעולה
- הידרוליזת ATP והמרת אנרגיה
- הכרה בחבילות ומאפייני קישור
- דרכי תחבורה תוך-תאיות
- רגולציה של פעילות קינזין
- קינזין בתפקוד נוירונלי ותחבורה אקסונלית
- ניתוח השוואתי: קינזין מול דינאין ומיוזין
- מחלות הקשורות לקינזין ומטרות טיפוליות
- מחקרים מתפתחים וכיווני עתיד
- מקורות ומסמכים
הקדמה לחלבוני המנוע קינזין
חלבוני המנוע קינזין הם קבוצה יסודית של מנועים מולקולריים המשחקים תפקיד מרכזי בתחבורה תוך-תאית ובארגון התאים. הם התגלו באמצע שנות ה-80, וקינזינים הם חלבונים התלויים ב-ATP הנעים לאורך מסילות מיקרובובולות בתוך תאים אוקריוטיים, ומשנעים מגוון חבילות כמו אורגנלות, וזיקולות, חלבונים ו-mRNA. התחבורה הזו חיונית לתהליכים תאיים רבים, כולל מיטוזה, מיאוזה ותפקוד נוירונלי. משפחת הקינזינים גדולה ומגוונת, עם יותר מ-40 גני קינזין שונים זוהו בבני אדם, כל אחד מקודד לחלבונים עם פונקציות ספציפיות ומאפייני חבילה מיוחדים.
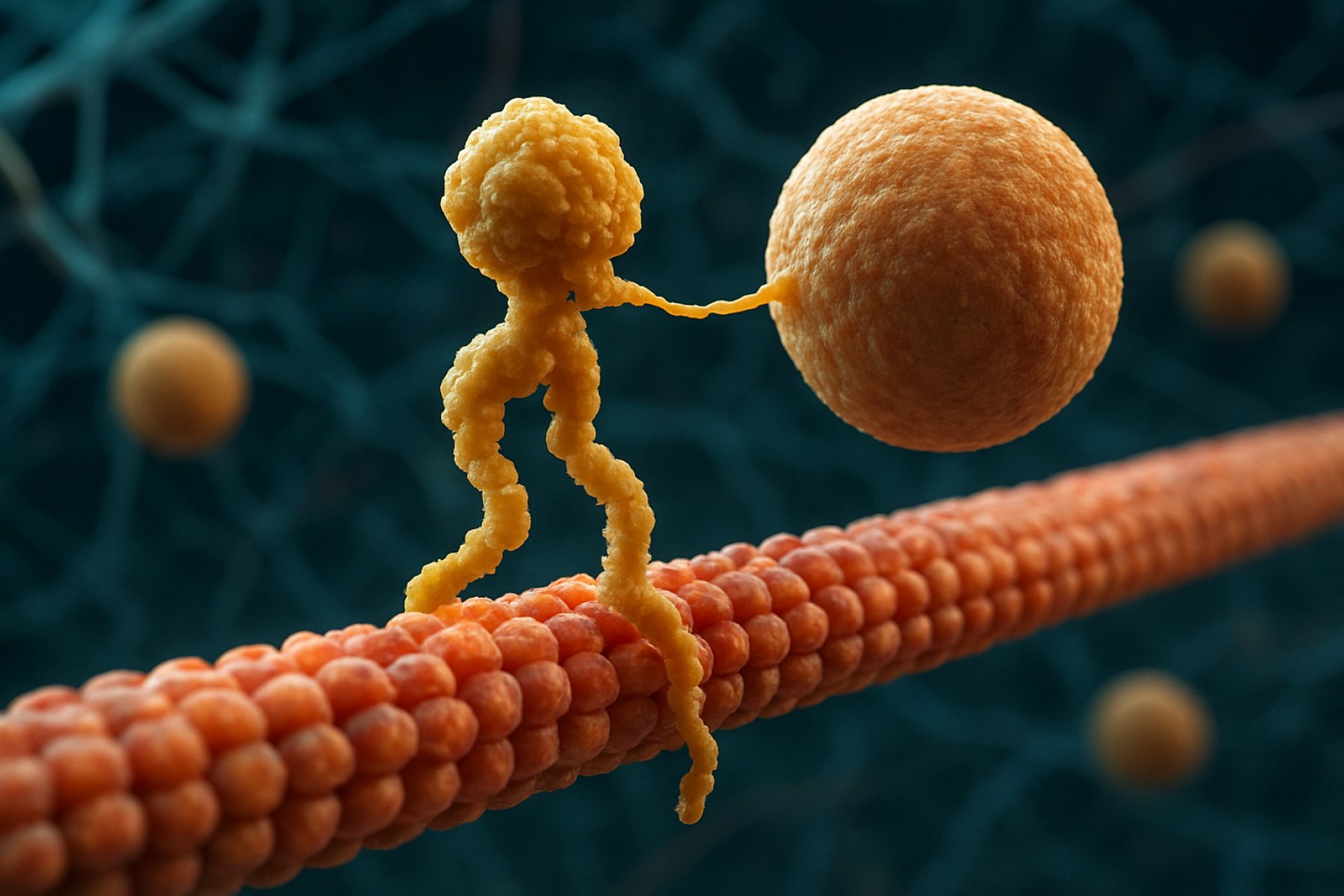
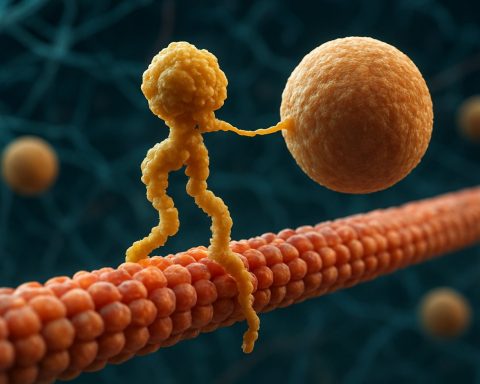
מבחינה מבנית, קינזינים מורכבים בדרך כלל משתי שרשרות כבדות ושתי שרשרות קלות. השרשרות הכבדות מכילות דומיין מנוע שומר על תאימות, הקושר את המיקרובובולות ומבצע הידרוליזת ATP כדי לייצר תנועה. דומיינים הזנב של קינזינים אחראים על קישור עם החבילות, מאפשרים למנוע לשנע רכיבי תא ספציפיים ליעדים שלהם. התנועה של קינזין בדרך כלל מכוונת לקצה החיובי של המיקרובובולות, אשר בדרך כלל תואם למעטפת התא, אם כי חלק מחברי משפחת הקינזינים נעים לכיוון הקצה השלילי.
המנגנון של תנועת קינזין מתואר לעיתים קרובות כתנועה "יד על גבי יד", בה שני הדומיינים המנועיים נקשרים ומניחים לסירוגין למיקרובובולה, כשהם מופעלים על ידי מחזורי קישור להידרוליזת ATP. תנועה זו מאפשרת לקינזינים לנוע למרחקים ארוכים לאורך המיקרובובולות מבלי להתנתק, מה שמקנה להם יעילות גבוהה כתובעים בתוך הסביבה התאית הצפופה. הרגולציה המדויקת של פעילות הקינזין חיונית לשמירה על הומיאוסטזיס ופונקציה תאית.
חלבוני המנוע קינזין לא רק חיוניים לפונקציות תאיות רגילות אלא גם מעורבים במגוון מחלות. ליקויים בתפקוד הקינזין נקשרו להפרעות נוירודגנרטיביות, כמו מחלת אלצהיימר ופראפלגיה ספסטית תורשתית, כמו גם לסוגי סרטן מסוימים. כתוצאה מכך, קינזינים הם נושא של מחקר אינטנסיבי, הן כדי להבין את הביולוגיה הבסיסית שלהם והן כדי לחקור את הפוטנציאל שלהם כמטרות טיפוליות.
המחקר על חלבוני המנוע קינזין נתמך ומתקדם על ידי ארגוני מדע מובילים ומכוני מחקר ברחבי העולם, כולל את ההמכונים הלאומיים לבריאות ואת הקבוצת פרסום נייטור, אשר מפרסמים באופן קבוע מחקרים שנבדקו על ידי עמיתים על המבנה, הפונקציה והחשיבות הביומדיקלית של חלבונים אלו. הלימוד המתמשך של קינזינים ממשיך לחשוף תובנות חדשות על המכונה המולקולרית של החיים ומציע הזדמנויות מבטיחות לפיתוח התערבויות רפואיות חדשות.
מבנה מולקולרי ומנגנון פעולה
חלבוני המנוע קינזין הם משפחה של מנועים מולקולריים התלויים ב-ATP ומשחקים תפקיד מכריע בתחבורה תוך-תאית, במיוחד לאורך מסילות מיקרובובולות. מבחינה מבנית, קינזינים מורכבים בדרך כלל משתי שרשרות כבדות ושתי שרשרות קלות, forming a heterotetrameric complex. השרשרות הכבדות מכילות דומיין מנוע שמור מאוד (המכונה גם "ראש"), עמוד שצורתו מתפתלת, ודומיין זנב קצה C. הדומיין המנועי אחראי על הקישור למיקרובובולות וההידרוליזה של ATP, המעניק את האנרגיה הנדרשת לתנועה. בניגוד לכך, דומיין הזנב מעורב בהכרה בקוראות ובקישור, לעיתים קרובות באינטראקציה עם חלבוני מתאם או ישירות עם וזיקולות ואורגנלות.
מנגנון הפעולה של חלבוני המנוע קינזין מתואר לעיתים קרובות כתנועת "יד על גבי יד". כל מולקולת קינזין מכילה שני דומיינים מנועים שמתממשקים לסירוגין עם המיקרובובולה, כשהם מתואמים על ידי קישור להידרוליזת ATP. כאשר ראש אחד נקשר למיקרובובולה ומבצע הידרוליזת ATP, הוא עובר שינוי תצורה שמניע את הראש השני קדימה לאתר הקישור הבא, במרחק של כ-8 ננומטר. תהליך זה חוזר שוב, מה שמאפשר לקינזין "ללכת" בכיוון אחד לאורך המיקרובובולה, בדרך כלל לקצה החיובי, המכוון למעטפת התא. הפעולה הקואורדינציה של שני הראשים מבטיחה תהליך, מה שאומר שהקינזין יכול לקחת מספר צעדים לאורך המיקרובובולה מבלי להתנתק, דבר שהוא חיוני להעברת חבילות ביעילות על פני מרחקים ארוכים בתוך התא.
קינזינים הם מאוד מגוונים, עם יותר מ-40 גני קינזין שונים שזוהו בבני אדם, כל אחד מהם מותאם לפונקציות תאיות ספציפיות. בעוד שברוב הקינזינים נעים לעבר הקצה החיובי של המיקרובובולה, כמה, כמו חברי משפחת קינזין-14, נעים לעבר הקצה השלילי, הממחיש את הרב-גוניות הפונקציונלית של משפחת חלבונים זו. פעילותם והכיווניות של הקינזינים נקבעות על ידי הבדלים קטנים בדומיינים המנועיים שלהם ובאזורים הרגולטוריים הנלווים.
המחקר על מבנה ופונקציה של קינזין התקדם בעזרת טכניקות ברזולוציה גבוהה כמו כריסטלוגרפיה קרינת-X ומיקרוסקופיה קריואלקטרונית, אשר חשפו תובנות מפורטות על השינויים התצורתיים שמבססים את תנועת המנועים הללו. הממצאים הללו היו מרכזיים בהבנת לא רק את ביולוגיית התא הבסיסית אלא גם את הבסיס המולקולרי של מחלות הקשורות לפunct.Hikari, כמו כמה הפרעות נוירודגנרטיביות וסוגי סרטן. ארגוני מחקר מובילים, כולל את ההמכונים הלאומיים לבריאות ואת המכון הביולוגיה המולקולרית האירופי, ממשיכים לחקור את המנגנונים המולקולריים של חלבוני המנוע קינזין, מדגישים את חשיבותם הבסיסית בביולוגיה של התא.
הידרוליזת ATP והמרת אנרגיה
חלבוני המנוע קינזין הם מכונות מולקולריות חיוניות הממירות אנרגיה כימית לעבודה מכנית, מאפשרות את התחבורה של חבילות תאיות שונות לאורך מיקרובובולות. התהליך הבסיסי העומד בבסיס תנועה זו הוא הידרוליזת אדנוזין טריפוספט (ATP), המספקת את האנרגיה הנדרשת לשינויים תצורתיים של קינזין ולתנועת הכיווניות.
ההידרוליזציה של ATP מתבצעת בדומיינים המנועיים (המכונים גם "ראשים") של דימר הקינזין. כל ראש מכיל אתר קישור נוקלאוטידי שמור מאוד הקושר להידרוליזת ATP לסירוגין. מחזור המנגנון מתחיל כאשר ראש אחד של קינזין, הקשור בחריפות למיקרובובולה, נקשר ל-ATP. חיבור זה יוצר שינוי תצורה באזור הקישור של הצוואר, ומניע את הראש האחורי קדימה בתנועה של "יד על גבי יד". כאשר הראש המוביל נקשר ליחידת הטובולין הבאה, ATP מנותח לאדנוזין דיפוספט (ADP) ולזרחן אנורגני (Pi), ושחרור אנרגיה שמומר לתנועה מכנית. שחרור ה-Pi והחלפת ה-ADP ל-ATP מחדש את המחזור, מה שמאפשר תנועה מתקדמת רציפה לאורך המיקרובובולה.
היעילות של המרת אנרגיה בקינזין היאRemarkable. כל מולקולת ATP שהומתה מביאה צעד של 8 ננומטר לאורך המיקרובובולה, עם אובדן אנרגיה מינימלי. היעילות הגבוהה הזו נובעת מהקישור הצמוד בין הידרוליזת ATP למנגנון הצעדים המכני. התהליך מוגדר בקפידה, מה שמבטיח שההידרוליזציה של ATP מתבצעת רק כאשר הראש של קינזין מצוי במיקום הנכון, ובכך מונע צריכת אנרגיה מיותרת.
הפעילות האדנוזינית של קינזין מושפעת גם מהנוכחות של חבילות והסוג הספציפי של חבר משפחת קינזין המעורב. לדוגמה, קינזין-1 הקונבנציונלי הוא מאוד תהליך, מסוגל לקחת מאות צעדים מבלי להתנתק מהמיקרובובולה, בעוד שחברי משפחת קינזין אחרים עשויים להיות בעלות רמות הידרוליזת ATP שונות והתנהגויות צעדים, המותאמות לפונקציות תאיות שלהם.
המחקר על הידרוליזת ATP והמרת אנרגיה בקינזין היה מרכזי בהבנת המנגנונים של תחבורה בתוך התאים ועקרונות רחבים יותר של תפקוד של מנועים מולקולריים. מחקרים בתחום זה נתמכים על ידי הארגוני מדע המובילים כמו ההמכונים הלאומיים לבריאות והקרן המדע הלאומית, אשר מממנים חקירות על הביולוגיה המבנית והביופיזיקה של חלבוני המנוע. התובנות שהושגו ממחקרים אלה יש השלכות על נוירוביולוגיה, חלוקת תאים, ופיתוח יישומים ננוטכנולוגיים המדמים מנועים ביולוגיים.
הכרה בחבילות ומאפייני קישור
חלבוני המנוע קינזין הם מכונות מולקולריות חיוניות המניעות מגוון רחב של חבילות תוך-תאיות לאורך מסילות מיקרובובולות, ומשחקות תפקיד מכריע בתהליכים כמו מיקום אורגנלות, תחבורת וזיקולות ומיטוזה. הספציפיות בה קינזינים מזהים ומקשרים את החבילות שלהם היא יסודית לדייקנות ולרגולציה של התחבורה התוך-תאית. ספציפיות זו מושגת באמצעות שילוב של תכונות מבניות, חלבוני מתאם ומנגנוני רגולציה.
משפחת הקינזינים מאופיינת על ידי דומיין מנוע שמור הקשור להידרוליזת ATP ולחיבור למיקרובובולות, אך פונקציות ההכרה והחיבור של החבילות מתווכות בעיקר על ידי דומיינים מתקדמים המשתנים. האזורים הללו שונים באופן משמעותי בין חברי משפחת הקינזינים, מה שמאפשר אינטראקציה סדרתית עם חבילות שונות. לדוגמה, קינזין-1 (המכונה גם קינזין הקונבנציונלי) משתמש בזנבו הקצה C כדי לקשור מגוון חבילות, כולל אורגנלות ויזיקולות, לעיתים באמצעות חלבוני מתאם כמו שרשראות קלות של קינזין (KLCs). KLCs מכילות מוטיבים חוזרים של טטרטריקופפטיד (TPR) המסייעים להכיר חלבונים משויכים לחבילות ספציפיות, ובכך מעניקים סלקטיביות לתהליך התחבורה.
חלבוני מתאם משחקים תפקיד מרכזי בשילוב קינזינים עם החבילות שלהם. חלבונים אלה יכולים להכיר סיגנלים או מוטיבים ספציפיים על פני השטח של החבילה, מה שמבטיח שרק החבילה המתאימה משונעת על ידי קינזין מסוים. לדוגמה, האינטראקציה בין KLCs לחברי משפחת JIP (חלבונים אינטראקציה עם קינאז JNK) מתועדת היטב בתחבורה נוירונלית, שבה JIPs מתפקדים ככוח הקישור לקינזין-1 לוזיקולות המכילות מולקולות סיגנל. חברי משפחת קינזין אחרים, כמו קינזין-3, משתמשים במתאמים שונים ובמבני דומיין זנב שונים כדי להשיג ספציפיות לחבילות, דבר הממחיש את המגוון של החבילות וההקשרים התאית שבהם פועלים הקינזינים.
רגולציה של קישור חבילות מושגת גם באמצעות שינויים פוסט-תרגומיים ואינטראקציות תחרותיות. פוספורילציה של זנבות קינזין או של חלבוני מתאם עשויה לשנות את הכוונה לקישור, לאפשר שליטה דינמית על חיבור ושחרור של חבילות בתגובה לאותות תאיים. בנוסף, כמה חבילות עשויות להתחרות על קישור לאותו קינזין, דבר שמוסיף שכבת רגולציה נוספת שמבטיחה את כיוון ההתפלגות של החבילות.
המחקר על הכרה בקוראות ומאפייני קישור בחלבוני המנוע קינזין הוא תחום מעניין המתרחב במהירות, עם השלכות להבנה של מחלות נוירודגנרטיביות, הפרעות תחבורה תוך-תאיות ופיתוח טיפוליות ממוקדות. ארגוני מחקר מובילים כמו ההמכונים הלאומיים לבריאות והארגון הביולוגיה המולקולרית האירופי תומכים בחקירות מתמשכות על המנגנונים המולקולריים המנחים את אינטראקציות קינזין-חבילות, מדגישים את החשיבות הביומדיקלית של תחום זה.
דרכי תחבורה תוך-תאיות
חלבוני המנוע קינזין הם מכונות מולקולריות חיוניות המניעות תחבורה תוך-תאית לאורך מסילות מיקרובובולות, מבטיחות משלוח מדויק של אורגנלות, וזיקולות, חלבונים וחבילות אחרות בתוך תאים אוקריוטיים. מנועים אלה התלויים ב-ATP מאופיינים ביכולת שלהם להמיר אנרגיה כימית לעבודה מכנית, מה שמקל על תנועת רכיבי תא על פני מרחקים ארוכים עם כיווניות וספציפיות מרשימים.
מבחינה מבנית, קינזינים מורכבים בדרך כלל משני שרשרות כבדות המהוות דימר, כל אחת עם דומיין מנוע עגלגל (ראש) הקשור למיקרובובולות ומבצע הידרוליזת ATP. דומיינים הזנב אחראים על הכרה בקוראות ובקישור, לעיתים בשיתוף פעולה עם שרשרות קלות או חלבוני מתאם. החבר המפורסם ביותר, קינזין-1, נע בעיקר לעבר הקצה החיובי של המיקרובובולות, מה שמתאים בדרך כלל למעטפת התא, ובכך משחק תפקיד מרכזי בתחבורה אנטרוגרודית.
המנגנון של תנועת קינזין מתואר לעיתים כצעדים "יד על גבי יד", שבו שני הדומיינים המנועיים נקשרים והולכים לסירוגין לאורך הרשת המיקרובובולה. כל צעד נקשר בקפידה להידרוליזציה של מולקולת ATP אחת, מה שמבטיח רציפות וכיווניות. תנועה מתואמת זו מאפשרת לקינזינים לשנע חבילות על פני מרחקים שיכולים לזרום לאורך כל אורך נוירון או סוגי תאים גדולים אחרים.
קינזינים מסווגים למספר משפחות בהתבסס על זיקה רצף והנחיות פונקציונליות. בעוד שקינזין-1 מעורב בעיקר בהעברת אורגנלות וזיקולות, משפחות אחרות כמו קינזין-2 וקינזין-3 יש תפקידים ייחודיים בתחבורה צילייתית ובתחבורת וזיקולות סינפטיות, בהתאמה. כמה קינזינים, כמו קינזין-5, מעורבים בדינמיקה של מיתרים מיטוטיים במקום בתחבורה חבולות, מה שממחיש את הפונקציות המגוונות בתוך המשפחה של חלבונים זו.
הפעילות של מנועי קינזין מוזנת בקפידה על ידי נתיבי איתות תאיים, שינויים פוסט-תרגומיים ואינטראקציות עם חלבונים הקשורים למיקרובובולות. רגולציה זו מבטיחה שהחבילות מסולקות למיקומים תת-תאיים נכונים בתגובה לצרכים פיזיולוגיים. שיבושי תחבורה הנוגעים לקינזין נקשרו למחלות שונות, כולל הפרעות נוירודגנרטיביות, שבהן תחבורה אקסונלית לקויה תורמת להפרעות ותמותת נוירונים.
המחקר על חלבוני המנוע קינזין ממשיך להרחיב את הבנתנו על הלוגיסטיקה התאית ונעשה השראה לפיתוח מכשירים נאנו-ביומימטים. ארגוני מדע מובילים כמו ההמכונים הלאומיים לבריאות והקבוצת פרסום נייטור מפרסמים באופן קבוע מחקרים ויסודיים וסקירות על המבנה, הפונקציה והחשיבות הביומדיקלית של מנועי קינזין, מדגישים את תפקידם המרכזי בביולוגיה של התאים.
רגולציה של פעילות קינזין
חלבוני המנוע קינזין הם מכונות מולקולריות חיוניות המניעות חבילות לאורך מיקרובובולות בתוך תאים אוקריוטיים. רגולציה של פעילות הקינזין חיונית לשמירה על ארגון התאים, להבטיח חלוקה תקינה של אורגנלות ולתמוך בתהליכים כמו מיטוזה ותפקוד נוירונלי. יש מספר שכבות של רגולציה ששומרות על פעולות הקינזינים, פיקוח על מתי, היכן ואיך קינזינים משנים את אינטראקציה שלהם עם החבילות ומסילות המיקרובובולות.
מנגנון רגולציה אחד עיקרי הוא דרך אוטואיניביציה. רבים מחברני משפחת הקינזינים, כמו קינזין-1, יש דומיינים זנב שיכולים להתכווץ אחורה ולשנות אינטראקציה עם הדומיינים המנועיים, מה שמונע פעילות ATPase וקישור למיקרובובולה בהיעדר חבילות. מצב האוטואיניביציה הזה משתחרר כאשר חבילה נקשרת, מה שמעורר שינוי תצורה שמפעיל את המנוע כדי להשתלם. מנגנון זה מבטיח أن קינזינים פעילים רק כאשר יש צורך, ומונע צריכת ATP מיותרת ונזק פוטנציאלי לתא.
שינויים פוסט-תרגומיים (PTMs) גם משחקים תפקיד משמעותי במודולציה של פעילות הקינזין. פוספורילציה היא השינוי הפוסט-תרגומי המדובר ביותר, עם קינאזות כמו קינאזות תלויות בנוגדי גידול (CDKs) וכינאזות של סינתזת גליקוגן 3 (GSK3) הפוספורילציה של שיירים מסוימים על חלבוני קינזין. שינויים אלו יכולים לשפר או לעכב את הפעילות של המנוע, בהתאם להקשר ולחלבון הקינזין הספציפי המעורב. לדוגמה, פוספורילציה של קינזין-1 על ידי GSK3 מעכבת את היכולת שלו לקשור מיקרובובולות, ובכך מווסתת את התחבורה האקסונלית בנוירונים.
חלבוני מתאם הקשורים לחבילות מתמודדים עם רגולציה נוספת של קינזין. מתאמים אלה, כמו JIP1 ו-Milton, מקשרים קינזינים לחבילות ספציפיות ויכולים למודול את פעולת המנוע על ידי יציבות במצב הפעיל או מגייסים גורמים רגולטוריים נוספים. ההשפעה בין המתאמים והמנועים מאפשרת שליטה מרחבית וזמן מדויק של משלוח חבילות, דבר שהוא קריטי במיוחד בתאים ממורכזים ומקוטבים כמו נוירונים.
בנוסף, מידות המיקרובובולות יכולות להשפיע על פעילות הקינזין. חלבוני המיקרובובולות הקשורים (MAPs) ושינויים פוסט-תרגומיים בטובלין (כמו אצטילציה או דטירוזינציה) עשויים לשנות את הכוונה לקישור ואת התנועתיות של הקינזינים, ובכך להנחות או להגביל את תנועתם לאורך תתי קבוצות מסוימות של מיקרובובולות.
רגולציה של חלבוני המנוע קינזין היא נושא של מחקר מתמשך, עם השלכות להבנה של הפרעות נוירודגנרטיביות, סרטן והפרעות התפתחותיות. ארגונים מובילים כמו ההמכונים הלאומיים לבריאות והקבוצת פרסום נייטור תומכים ומפיצים מחקרים בתחום זה, המדגישים את חשיבות הרגולציה של קינזין בבריאות ובמחלה.
קינזין בתפקוד נוירונלי وתחבורה אקסונלית
חלבוני המנוע קינזין הם משפחת מנועים מולקולריים התלויים ב-ATP ומשחקים תפקיד מכריע בתחבורה תוך-תאית, במיוחד בסביבה המנוגדת של נוירונים. חלבונים אלה נעים לאורך מסילות מיקרובובולות, ממירים אנרגיה כימית מהידרוליזת ATP לעבודה מכנית, המאפשרת את התנועה המדויקת של חבילות תאיות שונות. בנוירונים, קינזינים חיוניים עבור תחבורת אורגנלות, פרוקטורס וזיקולות סינפטיות, חלבונים ו-mRNAs מגוף התא (סומה) לקצה האקסון, תהליך הידוע בשם תחבורה אקסונלית אנטרוגרודית.
משפחת הקינזינים היא מגוונת, עם יותר מ-40 גני קינזין שונים שזוהו בבני אדם, כל אחד מקודד לחלבונים עם פונקציות ספציפיות ומאפייני חבילה. החבר המוכר ביותר, קינזין-1 (המכונה גם קינזין הקונבנציונלי), הוא הטרוטטמר המורכב משתי שרשראות כבדות ושתי שרשרות קלות. השרשרות הכבדות מכילות את הדומיינים המנועיים האחראיים להידרוליזת ATP ולקישור למיקרובובולות, בעוד ששרשרות הקלות מעורבות בהכרה ובקישור של החבילות. ארגון מבני זה מאפשר לקינזין-1 לשנע מגוון רחב של חבילות חיוניות לתפקוד והישרדות נוירונלית.
תחבורה אקסונלית היא חיונית לשמירה על בריאות ותפקוד נוירונלי, בהתחשב באורך הקצה של כמה אקסונים, המגיעים עד למטר בנוירונים אנושיים. תחבורה אנטרוגרודית על ידי קינזין מבטיחה משלוח בזמן של רכיבי סינפסה, מיטוכונדריה ואורגנלות חיוניות אחרות לאזורים שונים של הנוירון. שיבושים בתפקוד הקינזין יכולים להוביל לבעיות בשידור סינפטי, להתפתחות של נוירונים, והוזכרו בכמה ממחלת הנוירודגנרטיביות, כולל מחלת אלצהיימר ואמיו-טרופית סטרומפוסטית (ALS). חשיבות תחבורה המונעת על ידי קינזין בבריאות נוירונלית הודגשה על ידי מחקרים מארגוני מדע ייחודיים כמו ההמכונים הלאומיים לבריאות ומכון של נוירולוגיית הפרעות ומחלה, שציינו את הקשר בין ליקויים בתחבורה האקסונלית לדגנרציה נוירולוגית.
בנוסף לתחבורה אנטרוגרודית, קינזינים מתוארים גם לשיתוף פעולה עם חלבוני המנוע דינאין, שמבצעים תחבורה רטרוגרודית (מהקצה הנוירוני חזרה לסומה), כדי לשמור על שינוע החומר הנדרש להומיאוסטזיס של הנוירון. הרגולציה המדויקת של פעילות קינזין, בחירת החבבות, ותיאום עם חלבוני מנוע אחרים הם נושא של מחקר מתמשך, עם השלכות להבנה של הבסיס המולקולרי של חיבוריות נוירונלית, פלסטיות, ומחלות.
ניתוח השוואתי: קינזין מול דינאין ומיוזין
חלבוני המנוע קינזין הם קבוצה יסודית של מנועים מולקולריים הממלאים תפקיד חשוב בתחבורה תוך-תאית, במיוחד לאורך מסילות מיקרובובולות. כדי להעריך את חשיבותם הביולוגית בשלמותם, יש להשוות את הקינזינים לשתי משפחות תאי המנועות האחרות הגדולות: דינאינים ומיוזינים. כל אחד מחלבוני המנוע הללו מותאם במיוחד לתנועה לאורך מיקרופילמנטים שונים ומותאם לפונקציות תאיות ספציפיות.
קינזינים ודינינים שניהם עוברים מיקרובובולות, אך הם נבדלים בכיווניות ובספציפיות החבילות שלהם. קינזינים בדרך כלל נעים לעבר הקצה החיובי של המיקרובובולות, שיהיה בדרך כלל ממוקד לעבר מעטפת התא, מה שמקל על תחבורה אנטרוגרודית של אורגנלות, וזיקולות ומעריכי חלבונים. בניגוד לזה, דינינים נעים לקצה השלילי של המיקרובובולות, מכוונים חבילות לעבר מרכז התא, כמו גרעין או מרכז הארגון של המיקרובובולות. מערכת דו-כיוונית זו מבטיחה פיזור יעיל ומחזור של רכיבים תאיים. במבנה, קינזינים הם בדרך כלל חלבונים הומודימריים או הטרודימריים עם שני דומיינים מנועים, בעוד דיניינים ציטופלסמטיים הם קומפלקסים גדולים מרובי תתי יחידות עם מנגנון מורכב יותר של ייצור ושל רגולציה (המכון הלאומי לגנטיקה).
מיוזינים, לעומת זאת, הם חלבוני מנוע המתבססים בעיקר על אקטין. הם ידועים במיוחד על תפקידם בהתכווצות שריר, אך הם גם משתתפים במגוון תהליכים תאיים שאינם שריר, כמו יצירת דיפרנציאציה של התא, תחבורה של וזיקולות ותזוזת התאים. בניגוד לקינזינים ודינינים, הנעים לאורך המיקרובובולות, מיוזינים נעים לאורך מיקרופילמנטים, בדרך כלל לקראת הקצה החיובי (האדום). הארגון המבני של מיוזינים ייחודי, עם דומיין ראשוני שמקשר אקטין והידרוליזת ATP, אזור צוואר, וזנב שמגדיר את ספציפיות החבילות (המכונים הלאומיים לבריאות).
מהזווית הפונקציונלית, שלוש משפחות מנועיות מותאמות למסילות הציטוסקלאטיות המיועדות להן ולתפקידים תאיים ספציפיים. קינזינים הם חיוניים עבור תחבורה מדויקת ודינמית בנוירונים ובתאים מתחלקים, בעוד דינינים חיוניים עבור תחבורה רטרוגרודית ותנועות צילייתיות/דלבריות. מיוזינים, לעומת זאת, מרכזיים בתהליכים שדורשים ייצור כוח ותחבורה קצרה על רשתות אקטין. האינטראקציות בין מנועים אלה מבטיחות את הארגון הדינמי והקלה של התא האוקריוטי.
לסיכום, בעוד שקינזינים, דינינים ומיוזינים חולקים את התכונה הבסיסית של המרת אנרגיה כימית מהידרוליזת ATP לעבודה מכנית, הם מותאמים לדימויים שונים, לכיוונים ולתפקודים תאיים שונים. פעולותם המאוחדות הן חיוניות לשמירה על האדריכלות של התא, איתות והומיאוסטזיס.
מחלות הקשורות לקינזין ומטרות טיפוליות
חלבוני המנוע קינזין הם מכונות מולקולריות חיוניות המניעות חבילות תאיות שונות לאורך מיקרובובולות, ומשחקות תפקיד מרכזי בהובלת תהליכים תוך-תאיים, מיטוזה ותפקוד נוירונלי. השפעה של ליקויי קליטה או מימצא במחלות גנטיות הקשורות לגנים קינזין התאפשרו בעשרות מחלות המפותחות, מעודדות לבריאותם של אלה שהתוודעו אליהן.
אחת מהאסוציאציות המוכרות ביותר למחלות כרוכה ב-KIF1A, חבר במשפחת הקינזינים. מוטציות בגן KIF1A נקשרו לספקטרום של הפרעות נוירודגנרטיביות, שנקראות ביחד כהפרעות נוירולוגיות הקשורות ל-KIF1A (KAND). מצבים אלו מתבטאים כאי-סבילות אינטלקטואלית, פראפלגיה ספסטית ודגנרציה נוירולוגית מתקדמת. הפתולוגיה הבסיסית משוייכת לעיתים קרובות לתחבורה אקסונלית לקויה, אשר פוגעת בתפקוד הסינפטי ובקיום הנוירונים. באופן דומה, מוטציות בגני קינזין נוספים כמו KIF5A ו-KIF21A קשורות לפראפלגיה ספסטית תורשתית ולפיברוזיס מולד של השרירים החיצוניים, בהתאמה, מה שממחיש את התפקיד החיוני של קינזינים בבריאות מערכת העצבים.
מעבר לטרנספורמציה נוירודגנרטיבית, חלבוני המנוע קינזין מעורבים גם בסרטן. לדוגם, KIF11 (המכונה גם Eg5) חיוני לצורת הסיב הלפני ה-מיטי כשתאי מחולקים. מעודדות כמויות גבוהה או פעילות יתר של KIF11 נראו בטרנז לוקטור סרטן נשים כמו סרטן השד וסרטן הערמונית, שם היא לא עוקבת אחרי תהליך ההתפתחות הלקויה. כתוצאה מכך, KIF11 הפכה למטרה מבטיחה עבורטיפול סרטן אנטי-מיטוטי. מספר מעכבים של KIF11, כמו ispinesib, נכנסו לניסויים קליניים, שמטרתן היא לשבש את חלוקת תאי הסרטן במדויק תוך שמירה על תאים רגילים. הפיתוח וההערכה של מעכבים אלה מנותחים בקפדנות על ידי ארגונים רגולטוריים ומחקריים כמו ההמכון הלאומי לסרטן והמינהל המזון והתרופות האמריקאי.
אסטרטגיות טיפוליות הממוקדות בחלבוני המנוע קינזין מתחזקות ומחזקות את נגיף אוולציה. בהפרעות נוירודגנרטיביות, חסרונות ב-UCP, המלאות או כולל גבוה של חלבוני קינזין יכולים לגרום לפועל כאילו לעמוד או להרגיש פחות רגישים להוראות העדכון.
בנוסף, מחקרים מתבצעים על ידי ארגונים כמו ההמכונים הלאומיים לבריאות, הם חוקרים את פעילות הגן והדרכים לתקן דפוסי קינזין כדי לשחזר את התפקוד בטיפול לקויות גנטיות.
לסיכום, חלבוני המנוע קינזין ממלאים תפקיד מרכזי בבריאות התא, וחריגות בפעולתם משוייכות למגוון מחלות, במיוחד במערכת העצבים ובסרטן. מאמצי מחקר ופיתוח קליני המתמשכים חוקרים את הקינזינים הן כמקורות ומטרות טיפוליות, עם פוטנציאל להביא לטיפולים חדשים עבור תנאים שלא ניתן להתמודד איתם כיום.
מחקרים מתפתחים וכיווני עתיד
המחקר המתפתח על חלבוני המנוע קינזין מקדם במהירות את הבנתנו את תפקידם בתהליכים תהליכיים ואת הפוטנציאל שלהם בביוטכנולוגיה ורפואה. קינזינים הם משפחת מנועים מולקולריים התלויים ב-ATP המעבירים חבילות לאורך מסילות מיקרובובולות, משחקים תפקידים חיוניים בתחבורה תוך-תאית, מיטוזה ותפקוד נוירונלי. התקדמות האחרונה בטכניקות דימות ברזולוציה גבוהה ובביופיזיקה של מולקולות בודדות אפשרו לחוקרים לראות דינמיקה של קינזין בפרטים חסרי תקדים, חושפים תובנות חדשות על מחויבויותיהם המכנית והתקנות שלהם.
כיוון אחד מבטיח כולל את הבהרת המגוון המבני של קינזין והשלכותיו על ספציפיות לחבילות ורגולציה. טכניקות ביו-מדעיות, כמו מיקרוסקופיה קריואלקטרונית, חשפו מצבים תצורתיים ייחודיים של חברי משפחת קינזין, המסup寄 забеляхחעליות מודרניות לעינדח. ידע מובנה זה מפשיט את העיצוב של מולקולות וצורות קטנות המותאמות שמותאמות לאקטיבציה של קינזין, עם פוטנציאל יישומי טיפולים במחלות נוירודגנרטיביות ובסרטן, שבו פונקציה לקויה של קינזין מתקיימת מתנע.
ביולוגיה סינתטית גם מנצלת את מנועי קינזין להנדסה של מערכות תחבורה ננומטריות. באמצעות ניצול של תנועות הקינזינים, חוקרים מפתחים מכשירים ביומימטיים למשלוח תרופות ממוקדות ואחרי סולאליות. חידושים אלו יכולים לשנות את הרפואה המדויקת על ידי אפשרות תחבורה משווקת של סוגים טיפוליים בתוך תאים או רקמות.
תחום נוסף המתפתח הוא ללמוד את תפקיד הקינזינים בבריאות ובמחלות נוירונאליות. מוטציות בגני קינזין נקשרו לפראפלגיה ספסטית תורשתית, מחלת שר к"צאר ומחלות נוספות. מחקרים מתמשכים מכוונים להבהיר כיצד מוטציות אלו פוגעות בתחבורה האקסונלית ולזהות אסטרטגיות לשיקום פונקציה תקינה. ההמכונים הלאומיים לבריאות והמכון הלאומי להפרעות נוירולוגיות ושבץ תומכים ביוזמות לחקור את הבסיס המולקולרי של מחלות אלו ולפתח התערבויות ממוקדות.
במבט קדימה, האינטגרציה של מודלים חישוביים, מיקרוסקופיה מתקדמת וטכנולוגיות של עריכת גנים צפויה להאיץ את גילוי הביולוגיה של הקינזינים. מאמצים משותפת בין מוסדות אקדמיים, רשויות ממשלתיות וחברות ביוטכנולוגיה מעודדות את תרגום מחקר בסיסי למיישומם קליניים ותעשייתיים. ככל שהבנתנו את חלבוני המנוע קינזין מעמיקה, יופו הזדמנויות חדשות להרגיש קידום טכנית בתעבורה תוך-תאית, את אבחון המחלות ואת היכולת לתכנן אסטרטגיות טיפוליות פורצות דרך.
מקורות ומסמכים
- המכונים הלאומיים לבריאות
- קבוצת פרסום נייטור
- המכון האירופי לביולוגיה מולקולרית
- הקרן הלאומית למדע
- הארגון האירופי לביולוגיה מולקולרית
- המכון הלאומי לגנטיקה
- המכון הלאומי לסרטן