Proteine Motorie Kinesina: I Motori Dinamici che Guidano la Logistica Intracellulare. Scopri Come Queste Macchine Molecolari Rivoluzionano la Funzione e la Salute Cellulare.
- Introduzione alle Proteine Motorie Kinesina
- Struttura Molecolare e Meccanismo d’Azione
- Idrolisi dell’ATP e Conversione di Energia
- Riconoscimento del Carico e Specificità di Legame
- Vie di Trasporto Intracellulare
- Regolazione dell’Attività della Kinesina
- Kinesina nella Funzione Neurale e nel Trasporto Assonale
- Analisi Comparativa: Kinesina vs. Dineina e Miosina
- Malattie Correlate alla Kinesina e Obiettivi Terapeutici
- Ricerche Emergenti e Direzioni Future
- Fonti e Riferimenti
Introduzione alle Proteine Motorie Kinesina
Le proteine motorie kinesina sono una classe fondamentale di motori molecolari che svolgono un ruolo critico nel trasporto intracellulare e nell’organizzazione cellulare. Scoperte a metà degli anni ’80, le kinesine sono proteine dipendenti dall’ATP che si muovono lungo i binari dei microtubuli all’interno delle cellule eucariotiche, trasportando una varietà di carichi come organelli, vescicole, proteine e mRNA. Questo trasporto è essenziale per numerosi processi cellulari, tra cui la mitosi, la meiosi e la funzione neuronale. La superfamiglia delle kinesine è ampia e diversificata, con oltre 40 diversi geni kinesina identificati nell’uomo, ciascuno codificante per proteine con funzioni specializzate e specificità di carico.
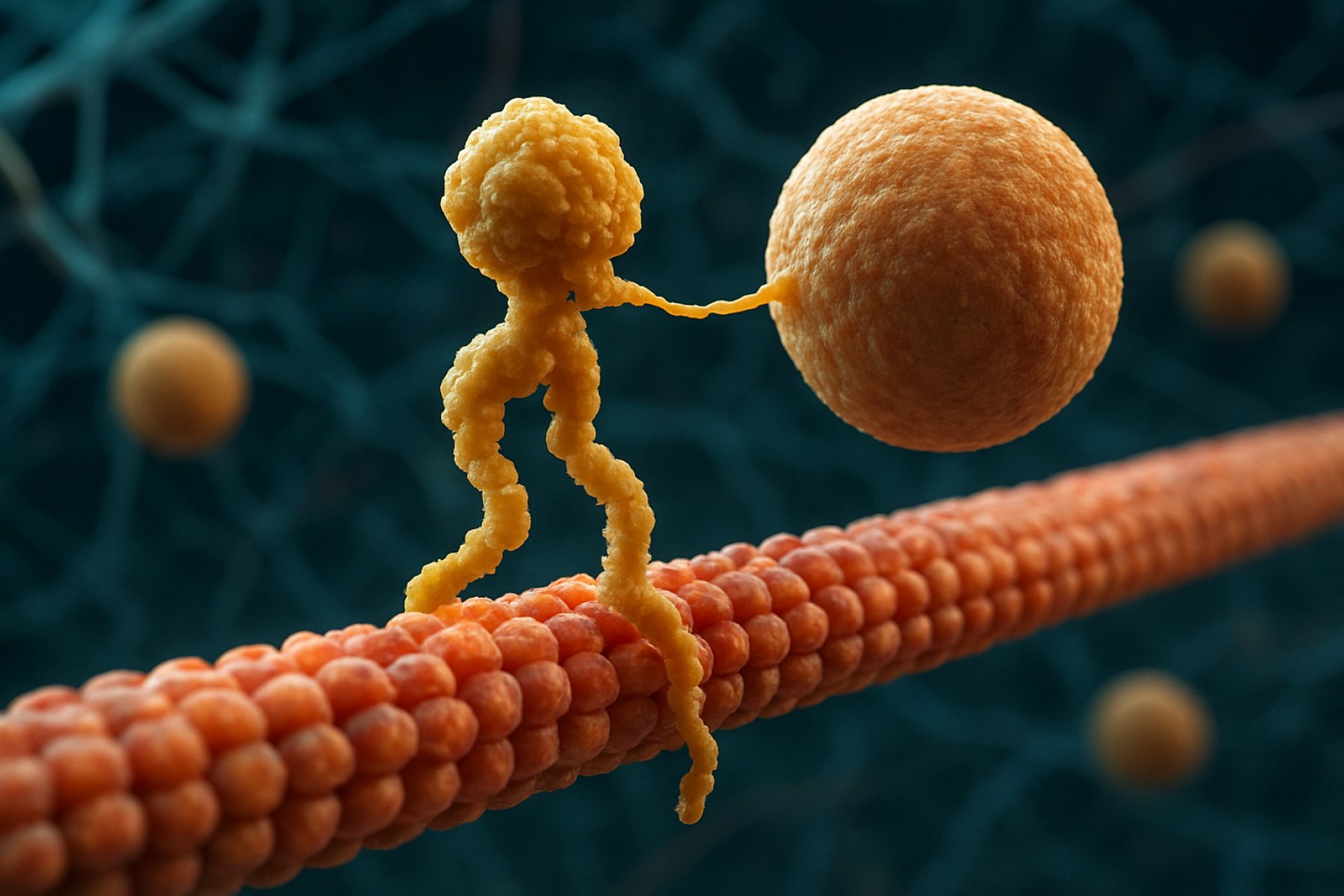
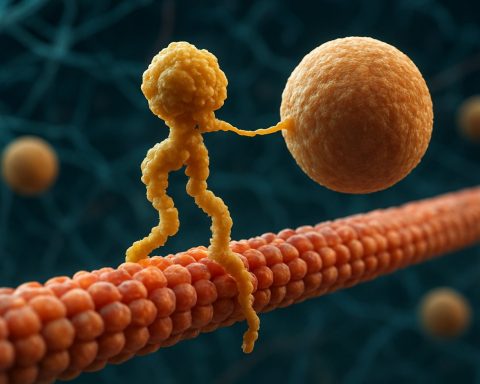
Strutturalmente, le kinesine sono tipicamente composte da due catene pesanti e due catene leggere. Le catene pesanti contengono un dominio motorio conservato, che si lega ai microtubuli e idrolizza l’ATP per generare movimento. I domini tail delle kinesine sono responsabili del legame con il carico, consentendo al motore di trasportare componenti cellulari specifici verso le loro destinazioni. Il movimento della kinesina è generalmente diretto verso l’estremità positiva dei microtubuli, che di solito corrisponde alla periferia della cellula, sebbene alcuni membri della famiglia delle kinesine si muovano verso l’estremità negativa.
Il meccanismo del movimento della kinesina è spesso descritto come un’azione di camminata “mano-in-mano”, dove i due domini motori si legano e rilasciano alternativamente il microtubulo, alimentati da cicli di legame e idrolisi dell’ATP. Questo movimento processivo consente alle kinesine di percorrere lunghe distanze lungo i microtubuli senza staccarsi, rendendole trasportatori altamente efficienti all’interno dell’ambiente cellulare affollato. La regolazione precisa dell’attività della kinesina è cruciale per mantenere l’omeostasi e la funzionalità cellulare.
Le proteine motorie kinesina non sono solo vitali per le normali operazioni cellulari, ma sono anche implicate in varie malattie. Difetti nella funzione della kinesina sono stati associati a disturbi neurodegenerativi, come la malattia di Alzheimer e la paraplegia spastica ereditaria, così come a certi tipi di cancro. Di conseguenza, le kinesine sono oggetto di intense ricerche, sia per comprendere la loro biologia di base che per esplorare il loro potenziale come obiettivi terapeutici.
La ricerca sulle proteine motorie kinesina è sostenuta e sviluppata da importanti organizzazioni scientifiche e istituti di ricerca in tutto il mondo, tra cui i National Institutes of Health e il Nature Publishing Group, che pubblicano regolarmente studi peer-reviewed sulla struttura, funzione e significato biomedico di queste proteine. Lo studio continuo delle kinesine continua a rivelare nuove intuizioni sulla macchina molecolare della vita e offre promettenti opportunità per lo sviluppo di nuove interventi medici.
Struttura Molecolare e Meccanismo d’Azione
Le proteine motorie kinesina sono una superfamiglia di motori molecolari dipendenti dall’ATP che svolgono un ruolo cruciale nel trasporto intracellulare, in particolare lungo i binari dei microtubuli. Strutturalmente, le kinesine sono tipicamente composte da due catene pesanti e due catene leggere, formando un complesso eterotetramerico. Le catene pesanti contengono un dominio motorio N-terminale altamente conservato (chiamato anche “testa”), un gambo a coiled-coil e un dominio tail C-terminale. Il dominio motorio è responsabile del legame con i microtubuli e dell’idrolisi dell’ATP, che fornisce l’energia necessaria per il movimento. In contrasto, il dominio tail è coinvolto nel riconoscimento e legame con il carico, interagendo spesso con proteine adattatrici o direttamente con vescicole e organelli.
Il meccanismo d’azione delle proteine motorie kinesina è spesso descritto come un’azione di camminata “mano-in-mano”. Ciascuna molecola di kinesina ha due domini motori che si legano e si staccano alternativamente dal microtubulo, coordinati dal legame e idrolisi dell’ATP. Quando una testa si lega al microtubulo e idrolizza l’ATP, subisce un cambiamento conformazionale che propelle l’altra testa in avanti verso il prossimo sito di legame, a circa 8 nanometri di distanza. Questo processo si ripete, consentendo alla kinesina di “camminare” in una direzione lungo il microtubulo, tipicamente verso l’estremità positiva, che è orientata verso la periferia della cellula. L’azione coordinata delle due teste assicura la processività, il che significa che la kinesina può fare molti passi lungo un microtubulo senza dissociarsi, il che è essenziale per un efficiente trasporto di carico su lunghe distanze all’interno della cellula.
Le kinesine sono altamente diversificate, con oltre 40 diversi geni kinesina identificati nell’uomo, ciascuno adattato per funzioni cellulari specifiche. Mentre la maggior parte delle kinesine si muove verso l’estremità positiva del microtubulo, alcune, come i membri della famiglia kinesina-14, si muovono verso l’estremità negativa, evidenziando la versatilità funzionale di questa famiglia di proteine. L’attività e la direzionalità delle kinesine sono determinate da sottili differenze nei loro domini motori e nelle regioni regolatorie associate.
Lo studio della struttura e funzione delle kinesine è stato avanzato da tecniche ad alta risoluzione come la cristallografia a raggi X e la crio-microscopia elettronica, che hanno rivelato approfondimenti dettagliati sui cambiamenti conformazionali che sottendono la loro motilità. Questi risultati sono stati strumentali nella comprensione non solo della biologia cellulare di base ma anche della base molecolare delle malattie collegate al malfunzionamento delle kinesine, come certi disturbi neurodegenerativi e tumori. Leading research organizations, including the National Institutes of Health and the European Molecular Biology Laboratory, continue to investigate the molecular mechanisms of kinesin motor proteins, underscoring their fundamental importance in cell biology.
Idrolisi dell’ATP e Conversione di Energia
Le proteine motorie kinesina sono macchine molecolari essenziali che convertono l’energia chimica in lavoro meccanico, abilitando il trasporto di vari carichi cellulari lungo i microtubuli. Il processo fondamentale alla base di questo movimento è l’idrolisi dell’adenosina trifosfato (ATP), che fornisce l’energia necessaria per i cambiamenti conformazionali della kinesina e per la motilità direzionale.
L’idrolisi dell’ATP avviene nei domini motori (chiamati anche “teste”) del dimer della kinesina. Ogni testa contiene un sito di legame nucleotidico altamente conservato che si lega alternativamente e idrolizza l’ATP. Il ciclo meccanico chimico inizia quando una testa della kinesina, strettamente legata al microtubulo, lega l’ATP. Questo legame induce un cambiamento conformazionale nella regione del connettore del collo, propellendo la testa posteriore in avanti in un movimento “mano-in-mano”. Quando la testa principale si lega al prossimo sottounità di tubulina, l’ATP è idrolizzato in adenosina difosfato (ADP) e fosfato inorganico (Pi), rilasciando energia che viene trasdotta in movimento meccanico. Il rilascio di Pi e lo scambio successivo di ADP con ATP ripristinano il ciclo, consentendo un movimento processivo continuo lungo il microtubulo.
L’efficienza della conversione dell’energia nella kinesina è notevole. Ogni molecola di ATP idrolizzata risulta in un passo di 8 nanometri lungo il microtubulo, con perdite di energia minime. Questa alta efficienza è attribuita al forte accoppiamento tra l’idrolisi dell’ATP e il meccanismo di passo meccanico. Il processo è altamente regolato, garantendo che l’idrolisi dell’ATP avvenga solo quando la testa della kinesina è correttamente impegnata con il microtubulo, prevenendo così spese energetiche inutili.
L’attività ATPasica della kinesina è anche modulata dalla presenza di carico e dal tipo specifico di membro della famiglia kinesina coinvolto. Ad esempio, la kinesina-1 convenzionale è altamente processiva, capace di fare centinaia di passi senza dissociarsi dal microtubulo, mentre altri membri della famiglia kinesina possono avere tassi di idrolisi dell’ATP e comportamenti di passo diversi, adattati alle loro funzioni cellulari.
Lo studio dell’idrolisi dell’ATP e della conversione di energia nella kinesina è stato cruciale per comprendere i meccanismi di trasporto intracellulare e i principi più ampi della funzione dei motori molecolari. La ricerca in questo campo è supportata da importanti organizzazioni scientifiche come i National Institutes of Health e la National Science Foundation, che finanziano indagini sulla biologia strutturale e sulla biofisica delle proteine motorie. Le intuizioni ottenute da questi studi hanno implicazioni per la neurobiologia, la divisione cellulare e lo sviluppo di applicazioni nanotecnologiche che imitano i motori biologici.
Riconoscimento del Carico e Specificità di Legame
Le proteine motorie kinesina sono macchine molecolari essenziali che trasportano una vasta gamma di carichi intracellulari lungo i binari dei microtubuli, svolgendo un ruolo cruciale in processi come il posizionamento degli organelli, il traffico delle vescicole e la mitosi. La specificità con cui le kinesine riconoscono e si legano ai loro carichi è fondamentale per la fedeltà e la regolazione del trasporto intracellulare. Questa specificità è raggiunta attraverso una combinazione di caratteristiche strutturali, proteine adattatrici e meccanismi regolatori.
La superfamiglia delle kinesine è caratterizzata da un dominio motorio conservato responsabile dell’idrolisi dell’ATP e del legame con i microtubuli, ma le funzioni di riconoscimento e legame con il carico sono principalmente mediate dai domini tail variabili. Queste regioni tail differiscono significativamente tra i membri della famiglia delle kinesine, consentendo l’interazione selettiva con carichi distinti. Ad esempio, la kinesina-1 (nota anche come kinesina convenzionale) utilizza il suo tail C-terminale per legarsi a una varietà di carichi, inclusi organelli legati alla membrana e vescicole, spesso attraverso proteine adattatrici come le catene leggere della kinesina (KLC). Le KLC contengono motivi di ripetizione tetratricopeptidica (TPR) che facilitano il riconoscimento di specifiche proteine associate al carico, conferendo così selettività al processo di trasporto.
Le proteine adattatrici svolgono un ruolo cruciale nel collegare le kinesine ai loro carichi. Questi adattatori possono riconoscere segnali o motivi specifici sulla superficie del carico, assicurando che solo il carico appropriato venga trasportato da una data kinesina. Ad esempio, l’interazione tra le KLC e i membri della famiglia JIP (proteine interagenti con la chinasi c-Jun N-terminale) è ben documentata nel trasporto neuronale, dove le JIP fungono da impalcature collegando la kinesina-1 alle vescicole contenenti molecole di segnalazione. Altri membri della famiglia kinesina, come la kinesina-3, utilizzano adattatori e strutture del dominio tail diverse per ottenere specificità di carico, riflettendo la diversità dei carichi e dei contesti cellulari in cui operano le kinesine.
La regolazione del legame del carico è anche ottenuta attraverso modifiche post-traduzionali e interazioni competitive. La fosforilazione delle tail della kinesina o delle proteine adattatrici può modulare l’affinità di legame, abilitando un controllo dinamico sull’attacco e il rilascio del carico in risposta ai segnali cellulari. Inoltre, alcuni carichi possono competere per il legame con la stessa kinesina, introducendo un ulteriore livello di regolazione che garantisce una corretta distribuzione del carico.
Lo studio del riconoscimento del carico e della specificità di legame nelle proteine motorie kinesina è un campo in rapida evoluzione, con implicazioni per comprendere le malattie neurodegenerative, i disturbi del traffico intracellulare e lo sviluppo di terapie mirate. Organizzazioni di ricerca leader come i National Institutes of Health e la European Molecular Biology Organization supportano indagini ongoing sui meccanismi molecolari sottostanti le interazioni kinesina-carico, evidenziando l’importanza biomedica di quest’area.
Vie di Trasporto Intracellulare
Le proteine motorie kinesina sono macchine molecolari essenziali che guidano il trasporto intracellulare lungo i binari dei microtubuli, garantendo la consegna precisa di organelli, vescicole, proteine e altri carichi all’interno delle cellule eucariotiche. Questi motori dipendenti dall’ATP sono caratterizzati dalla loro capacità di convertire energia chimica in lavoro meccanico, facilitando il movimento dei componenti cellulari su lunghe distanze con notevole direzionalità e specificità.
Strutturalmente, le kinesine consistono tipicamente in due catene pesanti che formano un dimero, ciascuna con un dominio motorio globulare (testa) che si lega ai microtubuli e idrolizza l’ATP. I domini tail sono responsabili del riconoscimento e del legame del carico, spesso in associazione con catene leggere o proteine adattatrici. Il membro meglio studiato, la kinesina-1, si muove principalmente verso l’estremità positiva dei microtubuli, che generalmente corrisponde alla periferia della cellula, svolgendo così un ruolo cruciale nel trasporto anterogrado.
Il meccanismo del movimento della kinesina è spesso descritto come un’azione di camminata “mano-in-mano”, dove i due domini motori si legano e avanzano alternativamente lungo il reticolo di microtubuli. Ogni passo è strettamente accoppiato all’idrolisi di una singola molecola di ATP, garantendo processività e direzionalità. Questo movimento coordinato consente alle kinesine di trasportare carichi su distanze che possono coprire l’intera lunghezza di un neurone o di altri tipi di cellule grandi.
Le kinesine sono classificate in più famiglie in base all’omologia della sequenza e alla specializzazione funzionale. Mentre la kinesina-1 è principalmente coinvolta nel trasporto di organelli e vescicole, altre famiglie come la kinesina-2 e la kinesina-3 hanno ruoli distinti nel trasporto ciliare e nel traffico delle vescicole sinaptiche, rispettivamente. Alcune kinesine, come la kinesina-5, sono coinvolte nella dinamica del fuso mitotico piuttosto che nel trasporto di carico, evidenziando la diversità funzionale all’interno di questa superfamiglia di proteine.
L’attività dei motori della kinesina è strettamente regolata da vie di segnalazione cellulare, modifiche post-traduzionali e interazioni con proteine associate ai microtubuli. Questa regolazione garantisce che i carichi siano consegnati alle corrette posizioni subcellulari in risposta alle esigenze fisiologiche. La perturbazione del trasporto mediato dalla kinesina è stata implicata in varie malattie, tra cui disturbi neurodegenerativi, dove il trasporto assontale difettoso contribuisce alla disfunzione e degenerazione neuronale.
La ricerca sulle proteine motorie kinesina continua ad avanzare la nostra comprensione della logistica cellulare e ha ispirato lo sviluppo di nanodispositivi biomimetici. Organizzazioni scientifiche di spicco come i National Institutes of Health e il Nature Publishing Group pubblicano regolarmente studi fondamentali e revisioni sulla struttura, funzione e significato biomedico dei motori kinesina, sottolineando il loro ruolo centrale nella biologia cellulare.
Regolazione dell’Attività della Kinesina
Le proteine motorie kinesina sono macchine molecolari essenziali che trasportano carichi lungo i microtubuli all’interno delle cellule eucariotiche. La regolazione dell’attività delle kinesine è cruciale per mantenere l’organizzazione cellulare, garantire la corretta distribuzione degli organelli e supportare processi come la mitosi e la funzione neuronale. Esistono più livelli di regolazione per controllare quando, dove e come le kinesine interagiscono con i loro carichi e le tracce di microtubuli.
Un meccanismo primario di regolazione è attraverso l’autoinibizione. Molti membri della famiglia delle kinesine, come la kinesina-1, possiedono domini tail che possono ripiegarsi e interagire con i loro domini motori, impedendo l’attività ATPasica e il legame con i microtubuli in assenza di carico. Questa confornazione autoinibita viene alleviata dopo il legame del carico, che induce un cambiamento conformazionale che attiva il motore per il movimento processivo. Questo meccanismo garantisce che le kinesine siano attive solo quando necessario, prevenendo così un consumo inutile di ATP e potenziali danni cellulari.
Le modifiche post-traduzionali (PTM) giocano anche un ruolo significativo nella modulazione dell’attività della kinesina. La fosforilazione è la PTM più studiata, con chinasi come le chinasi dipendenti da ciclina (CDK) e la chinasi del glicogeno sintasi 3 (GSK3) che fosforilano specifici residui sulle proteine kinesina. Queste modifiche possono sia potenziare che inibire l’attività del motore, a seconda del contesto e della kinesina specifica coinvolta. Ad esempio, la fosforilazione della kinesina-1 da parte della GSK3 inibisce la sua capacità di legarsi ai microtubuli, regolando così il trasporto assontale nei neuroni.
Le proteine adattatrici per il carico affinano ulteriormente la regolazione delle kinesine. Questi adattatori, come JIP1 e Milton, collegano le kinesine a carichi specifici e possono modulare l’attività del motore stabilizzando la conformazione attiva o reclutando ulteriori fattori regolatori. L’interazione tra adattatori e motori consente un controllo spaziale e temporale preciso sulla consegna del carico, che è particolarmente critico nelle cellule altamente polarizzate come i neuroni.
Inoltre, le tracce di microtubuli stesse possono influenzare l’attività delle kinesine. Le proteine associate ai microtubuli (MAP) e le modifiche post-traduzionali della tubulina (come acetilazione o detirosinazione) possono alterare l’affinità di legame e la motilità delle kinesine, guidando o restrigendo efficacemente il loro movimento lungo specifici sottoinsiemi di microtubuli.
La regolazione delle proteine motorie kinesina è oggetto di ongoing ricerca, con implicazioni per comprendere le malattie neurodegenerative, il cancro e i disturbi dello sviluppo. Organizzazioni di spicco come i National Institutes of Health e il Nature Publishing Group supportano e diffondono la ricerca in questo campo, evidenziando l’importanza della regolazione delle kinesine nella salute e nella malattia.
Kinesina nella Funzione Neurale e nel Trasporto Assonale
Le proteine motorie kinesina sono una superfamiglia di motori molecolari dipendenti dall’ATP che svolgono un ruolo cruciale nel trasporto intracellulare, in particolare nell’ambiente altamente polarizzato dei neuroni. Queste proteine si muovono lungo i binari dei microtubuli, convertendo l’energia chimica dall’idrolisi dell’ATP in lavoro meccanico, che consente il movimento diretto di vari carichi cellulari. Nei neuroni, le kinesine sono essenziali per il trasporto di organelli, precursori di vescicole sinaptiche, proteine e mRNA dal corpo cellulare (soma) al terminale assonale, un processo noto come trasporto assonale anterogrado.
La superfamiglia delle kinesine è diversificata, con oltre 40 diversi geni kinesina identificati nell’uomo, ognuno dei quali codifica per proteine con funzioni specializzate e specificità di carico. Il membro meglio caratterizzato, la kinesina-1 (nota anche come kinesina convenzionale), è un eterotetramero composto da due catene pesanti e due catene leggere. Le catene pesanti contengono i domini motori responsabili dell’idrolisi dell’ATP e del legame con i microtubuli, mentre le catene leggere mediano il riconoscimento e il legame con il carico. Questa organizzazione strutturale consente alla kinesina-1 di trasportare una vasta gamma di carichi critici per la funzione e la sopravvivenza neuronale.
Il trasporto assonale è vitale per mantenere la salute e la funzione neuronale, dato l’estremo lunghezza di alcuni assoni, che possono estendersi fino a un metro negli esseri umani. Il trasporto anterogrado guidato dalla kinesina assicura la consegna tempestiva di componenti sinaptici, mitocondri e altri organelli essenziali a regioni distali del neurone. La distruzione della funzione della kinesina può portare a deficit nella trasmissione sinaptica, degenerazione assontale e è stata implicata in diverse malattie neurodegenerative, tra cui la malattia di Alzheimer e la sclerosi laterale amiotrofica (SLA). L’importanza del trasporto mediato dalla kinesina nella salute neuronale è sottolineata dalla ricerca delle principali organizzazioni scientifiche come i National Institutes of Health e il National Institute of Neurological Disorders and Stroke, che hanno evidenziato il legame tra difetti nel trasporto assonale e neurodegenerazione.
Oltre al trasporto anterogrado, le kinesine coordinano anche il lavoro con le proteine motorie dineina, che mediano il trasporto retrogrado (dal terminale assonale di nuovo al soma), per mantenere il flusso bidirezionale di materiali necessario per l’omeostasi neuronale. La regolazione precisa dell’attività delle kinesine, la selezione del carico e il coordinamento con altre proteine motorie sono oggetto di ongoing ricerca, con implicazioni per comprendere la base molecolare della connettività neuronale, della plasticità e della malattia.
Analisi Comparativa: Kinesina vs. Dineina e Miosina
Le proteine motorie kinesina sono una classe fondamentale di motori molecolari che svolgono un ruolo critico nel trasporto intracellulare, in particolare lungo i binari dei microtubuli. Per apprezzare pienamente la loro significatività biologica, è essenziale confrontare le kinesine con le altre due principali famiglie di proteine motorie citoscheletriche: le dineine e le miosine. Ognuna di queste proteine motorie è specializzata per il movimento lungo filamenti citoscheletrici distinti ed è adattata per specifiche funzioni cellulari.
Le kinesine e le dineine attraversano entrambe i microtubuli, ma differiscono nella loro direzionalità e specificità di carico. Le kinesine si muovono generalmente verso l’estremità positiva dei microtubuli, che è tipicamente orientata verso la periferia cellulare, facilitando il trasporto anterogrado di organelli, vescicole e complessi proteici. In contrasto, le dineine si muovono verso l’estremità negativa dei microtubuli, direzionando il carico verso il centro della cellula, come il nucleo o il centro di organizzazione dei microtubuli. Questo sistema bidirezionale garantisce una distribuzione e un riciclaggio efficienti dei componenti cellulari. Strutturalmente, le kinesine sono tipicamente proteine omodimeriche o eterodimeriche con due domini motori, mentre le dineine citoplasmatiche sono complessi grandi e multi-subunitari con un meccanismo più intricato di generazione di forza e regolazione (National Institute of Genetics).
Le miosine, d’altra parte, sono principalmente proteine motorie basate sull’actina. Sono meglio conosciute per il loro ruolo nella contrazione muscolare, ma partecipano anche a una varietà di processi cellulari non muscolari, come la citodieresi, il trasporto di vescicole e la motilità cellulare. A differenza delle kinesine e delle dineine, che si muovono lungo i microtubuli, le miosine attraversano i filamenti di actina, di solito verso l’estremità positiva (barbata). L’organizzazione strutturale delle miosine è distinta, con un dominio caratteristico della testa che si lega all’actina e idrolizza l’ATP, una regione del collo e una coda che determina la specificità del carico (National Institutes of Health).
Funzionalmente, le tre famiglie di proteine motorie sono adattate ai rispettivi binari citoscheletrici e ruoli cellulari. Le kinesine sono cruciali per il trasporto direzionale a lungo raggio nei neuroni e nelle cellule in divisione, mentre le dineine sono essenziali per il trasporto retrogrado e il movimento ciliario/flagellare. Le miosine, in contrasto, sono centrali nei processi che richiedono generazione di forza e trasporto a breve raggio sulle reti di actina. L’interazione tra questi motori garantisce l’organizzazione dinamica e l’adattabilità della cellula eucariotica.
In sintesi, mentre le kinesine, le dineine e le miosine condividono la proprietà fondamentale di convertir l’energia chimica dall’ATP in lavoro meccanico, sono specializzate per diverse tracce, direzioni e funzioni cellulari. Le loro azioni coordinate sono vitali per mantenere l’architettura cellulare, la segnalazione e l’omeostasi.
Malattie Correlate alla Kinesina e Obiettivi Terapeutici
Le proteine motorie kinesina sono macchine molecolari essenziali che trasportano vari carichi cellulari lungo i microtubuli, svolgendo un ruolo cruciale nel traffico intracellulare, nella mitosi e nella funzione neuronale. La disregolazione o le mutazioni dei geni delle kinesine sono state implicate in una serie di malattie umane, rendendo queste proteine significative sia come biomarcatori che come potenziali obiettivi terapeutici.
Una delle associazioni con le malattie più ben documentate coinvolge il membro della famiglia kinesina KIF1A. Le mutazioni nel gene KIF1A sono collegate a uno spettro di disturbi neurodegenerativi, collettivamente denominati disturbo neurologico associato a KIF1A (KAND). Queste condizioni si manifestano come disabilità intellettiva, paraplegia spastica e neurodegenerazione progressiva. La patologia sottostante è spesso attribuita a un trasporto assonale compromesso, che interrompe la funzione sinaptica e la sopravvivenza neuronale. Allo stesso modo, le mutazioni in altri geni delle kinesine, come KIF5A e KIF21A, sono associate a paraplegia spastica ereditaria e fibrosi congenita dei muscoli extraoculari, rispettivamente, sottolineando ulteriormente il ruolo critico delle kinesine nella salute del sistema nervoso.
Oltre alla neurodegenerazione, le proteine motorie kinesina sono implicate anche nel cancro. Ad esempio, KIF11 (nota anche come Eg5) è essenziale per la formazione del fuso mitotico durante la divisione cellulare. L’iperespressione o l’iperattività di KIF11 è stata osservata in vari tipi di cancro, tra cui il cancro al seno e alla prostata, dove contribuisce alla proliferazione cellulare incontrollata. Di conseguenza, KIF11 è emerso come un promettente obiettivo per terapie anti-mitotiche nel cancro. Diversi inibitori a piccole molecole di KIF11, come l’ispinesib, sono entrati in sperimentazione clinica, con l’obiettivo di interrompere selettivamente la divisione delle cellule tumorali risparmiando le cellule normali. Lo sviluppo e la valutazione di questi inibitori sono monitorati attentamente da organizzazioni regolatorie e di ricerca come il National Cancer Institute e la U.S. Food and Drug Administration.
Le strategie terapeutiche che mirano alle proteine motorie kinesina si estendono oltre l’oncologia. Nelle malattie neurodegenerative, sono in corso sforzi per sviluppare molecole che possano ripristinare o modulare la funzione delle kinesine, potenzialmente alleviando i deficit del trasporto assonale. Inoltre, la ricerca sostenuta da organizzazioni come i National Institutes of Health sta esplorando approcci di terapia genica e piccole molecole per correggere o compensare l’attività difettosa delle kinesine nei disturbi genetici.
In sintesi, le proteine motorie kinesina sono centrali nella salute cellulare e il loro malfunzionamento è collegato a una varietà di malattie, in particolare nel sistema nervoso e nel cancro. Gli sforzi di ricerca e sviluppo clinico continuano ad esplorare le kinesine sia come biomarcatori che come obiettivi terapeutici, con il potenziale di fornire nuovi trattamenti per condizioni attualmente intrattabili.
Ricerche Emergenti e Direzioni Future
Le ricerche emergenti sulle proteine motorie kinesina stanno rapidamente espandendo la nostra comprensione dei loro ruoli nei processi cellulari e delle loro potenziali applicazioni nella biotecnologia e nella medicina. Le kinesine sono una superfamiglia di motori molecolari dipendenti dall’ATP che trasportano carichi lungo i microtubuli, svolgendo ruoli essenziali nel traffico intracellulare, nella mitosi e nella funzione neuronale. I recenti progressi nella microscopia ad alta risoluzione e nella biofisica delle singole molecole hanno permesso ai ricercatori di visualizzare la dinamica delle kinesine in dettagli senza precedenti, rivelando nuove intuizioni sui loro cicli meccanico-chimici e meccanismi regolatori.
Una direzione promettente coinvolge l’illustrazione della diversità strutturale delle kinesine e delle sue implicazioni per la specificità del carico e la regolazione. Tecniche di biologia strutturale, come la crio-microscopia elettronica, hanno rivelato stati conformazionali distinti dei membri della famiglia delle kinesine, suggerendo adattamenti specializzati per diversi compiti cellulari. Questa conoscenza strutturale sta informando la progettazione di piccole molecole e peptidi che possono modulare l’attività delle kinesine, con potenziali applicazioni terapeutiche nelle malattie neurodegenerative e nel cancro, dove la funzione aberrante delle kinesine è implicata nella patogenesi.
La biologia sintetica sta anche sfruttando i motori delle kinesine per progettare sistemi di trasporto a scala nanometrica. Sfruttando il movimento direzionale delle kinesine, i ricercatori stanno sviluppando dispositivi biomimetici per la somministrazione mirata di farmaci e l’assemblaggio molecolare. Queste innovazioni potrebbero rivoluzionare la medicina di precisione consentendo il trasporto controllato di agenti terapeutici all’interno delle cellule o dei tessuti.
Un’altra area emergente è lo studio del ruolo delle kinesine nella salute e nella malattia neuronale. Le mutazioni nei geni delle kinesine sono state collegate alla paraplegia spastica ereditaria, alla malattia di Charcot-Marie-Tooth e ad altri disturbi neurodegenerativi. La ricerca in corso mira a chiarire come queste mutazioni interrompano il trasporto assonale e a identificare strategie per ripristinare la funzione normale. I National Institutes of Health e il National Institute of Neurological Disorders and Stroke stanno supportando iniziative per indagare i fondamenti molecolari di queste malattie e sviluppare interventi mirati.
Guardando al futuro, l’integrazione della modellazione computazionale, della microscopia avanzata e delle tecnologie di editing genomico è prevista per accelerare le scoperte nella biologia delle kinesine. Gli sforzi collaborativi tra istituzioni accademiche, agenzie governative e aziende biotecnologiche stanno favorendo la traduzione della ricerca di base in applicazioni cliniche e industriali. Man mano che la nostra comprensione delle proteine motorie kinesine si approfondisce, emergeranno nuove opportunità per manipolare il trasporto intracellulare, diagnosticare malattie e progettare strategie terapeutiche innovative.
Fonti e Riferimenti
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute