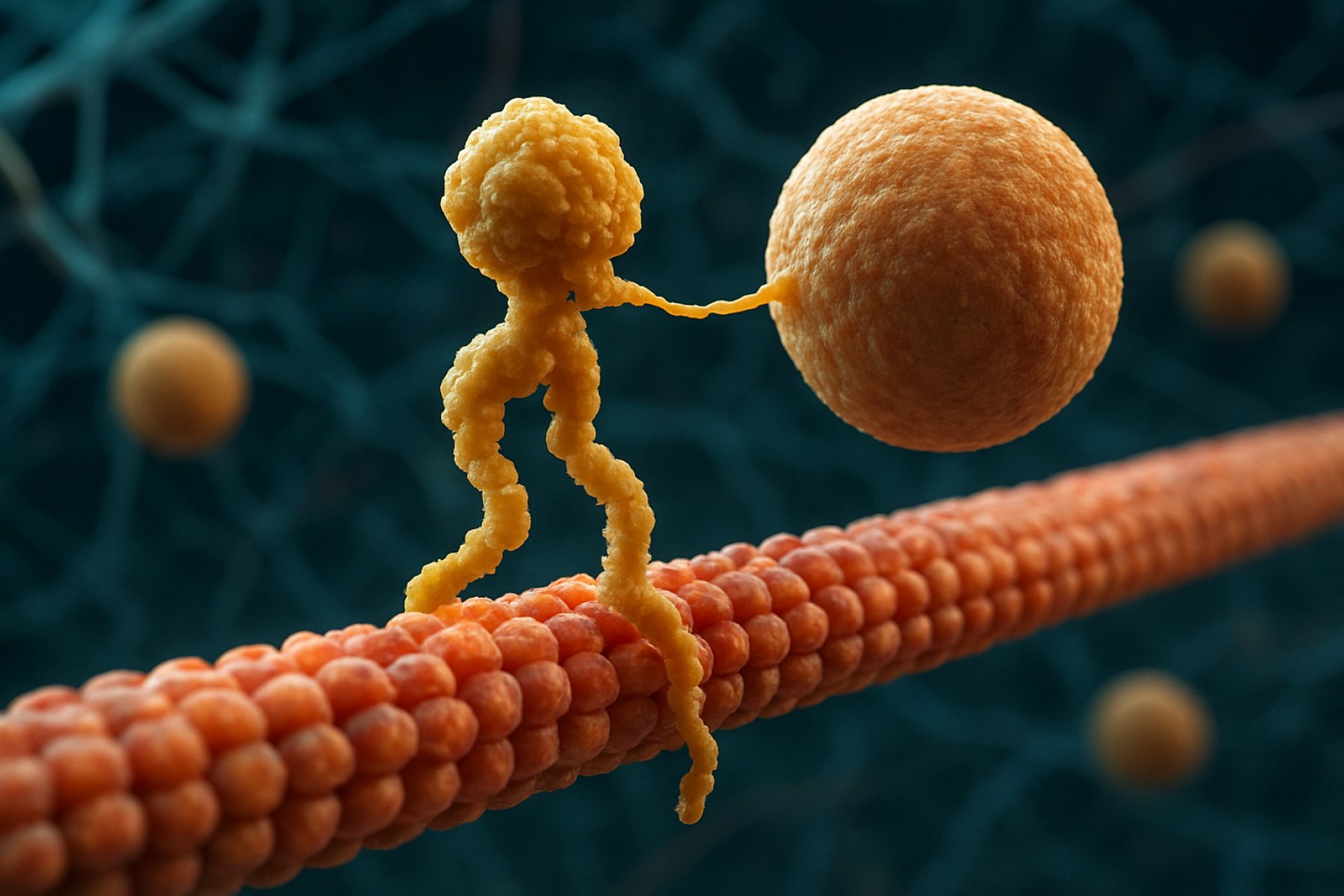
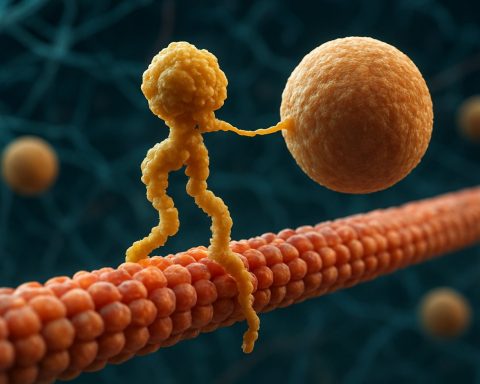
Kinesin Motorproteiner: Dei dynamiske motorane som driv intracellulær logistikk. Oppdag korleis desse molekylære maskinene revolusjonerer cellulære funksjonar og helse.
- Introduksjon til Kinesin Motorproteiner
- Molekylær Struktur og Mechanisme for Handling
- ATP Hydrolyse og Energiomforming
- Fraktgjenkjenning og Binding Spefifisitet
- Intracellulære Transportvegar
- Regulering av Kinesin Aktivitet
- Kinesin i Nevrale Funksjonar og Axonal Transport
- Samanliknande Analyse: Kinesin vs. Dynein og Myosin
- Kinesin-Relaterte Sjukdommar og Terapeutiske Mål
- Ny Forskning og Framtidige Retningar
- Kjelder & Referansar
Introduksjon til Kinesin Motorproteiner
Kinesin motorproteiner er ein grunnleggjande klasse av molekylære motorar som spelar ei kritisk rolle i intracellulær transport og cellulær organisering. Oppdaga på midten av 1980-talet, er kinesiner ATP-avhengige protein som rører seg langs mikrotubuli baner i eukaryote celler, og transporterer ei rekkje frakt som organellar, vesiklar, protein og mRNA. Denne transporten er essensiell for mange cellulære prosessar, inkludert mitose, meiosis og nevral funksjon. Kinesin-superfamilien er stor og variert, med over 40 forskjellige kinesin-gener identifisert hos menneske, kvar av dei koder for protein med spesialiserte funksjonar og fraktspefifisitetar.
Strukturelt er kinesiner typisk samansett av to tunge kjeder og to lette kjeder. Dei tunge kjedene inneheld eit bevart motorområde, som bind seg til mikrotubuli og hydrolyserer ATP for å generere rørsle. Halebanda til kinesiner er ansvarlege for fraktbinding, slik at motoren kan transportere spesifikke cellulære komponentar til sine tiltenkte destinasjonar. Rørsla til kinesin er generelt retta mot plussenden av mikrotubuli, som vanlegvis svarer til celleperiferien, sjølv om nokre kinesinfamilie-medlem rører seg mot minusenden.
Mekanismen for kinesins rørsle blir ofte beskriven som ein «hand-over-hand» gåande rørsle, der dei to motorområda wekkels bind seg til og slår laus frå mikrotubuli, drevet av syklar av ATP-binding og hydrolyse. Denne proksessive rørsla gjer at kinesiner kan reise lange avstandar langs mikrotubuli utan å løsne, noko som gjer dei svært effektive transportører i det trange cellulære miljøet. Den presise reguleringa av kinesinaktivitet er avgjerande for å oppretthalde cellulær homeostase og funksjon.
Kinesin motorproteiner er ikkje berre viktige for normale cellulære operasjonar, men er også involverte i ulike sjukdomar. Feil i kinesinfunksjon har blitt knytt til nevrodegenerative forstyrringar, som Alzheimer sin sjukdom og arvelig spastisk paraplegi, samt enkelte kreftformer. Som eit resultat er kinesiner gjenstand for intens forskning, både for å forstå deira grunnleggjande biologi og for å utforske deira potensial som terapeutiske mål.
Forskning på kinesin motorproteiner blir støtta og fremja av leiande vitenskaplege organisasjoner og forskningsinstitutt over heile verda, inkludert National Institutes of Health og Nature Publishing Group, som regelmessig publiserer fagfellevurderte studiar om strukturen, funksjonen og biomedisinsk betydning av desse proteinane. Den pågåande studien av kinesiner avslører stadig nye innsikter i den molekylære maskineriet av liv og tilbyr lovande vegar for utvikling av nye medisinske intervensjonar.
Molekylær Struktur og Mechanisme for Handling
Kinesin motorproteiner er ein superfamilie av ATP-avhengige molekylære motorar som spelar ein avgjerande rolle i intracellulær transport, spesielt langs mikrotubuli baner. Strukturelt består kinesiner typisk av to tunge kjeder som dannar ein dimer, kvar med eit globulært motorområde (hovud) som binder seg til mikrotubuli og hydrolyserer ATP. Halebanda er ansvarlege for fraktgjenkjenning og binding, ofte i samspel med lette kjeder eller adaptorproteiner. Den mest vel-studerte medlemmen, kinesin-1, rører seg overvektig mot plussenden av mikrotubuli, som generelt svarer til celleperiferien, og spelar dermed ei avgjerande rolle i anterograd transport.
Mekanismen for kinesins rørsle blir ofte beskriven som ein «hand-over-hand» gåande rørsle, der dei to motorområda vekselsvis bind seg til og steppar langs mikrotubuli gitteret. Kvar steg er tett knytt til hydrolysen av ein enkelt ATP-molekyl, noko som sikrar prosessivitet og retning. Denne koordinerte rørsla gjer at kinesiner kan transportere frakt over avstandar som kan spenne heile lengda av ein nevron eller andre store celletypar.
Kinesiner blir klassifiserte i fleire familier basert på sekvenshomologi og funksjonell spesialisering. Mens kinesin-1 er primært involvert i transport av organellar og vesiklar, har andre familier som kinesin-2 og kinesin-3 distinkte roller i cilie transport og synaptisk vesikkel transportering, respektivt. Nokre kinesiner, som kinesin-5, er involverte i mitotiske spindle dynamikk snarare enn frakttransport, noko som fremhever den funksjonelle variasjonen innan denne protein superfamilien.
Studien av kinesin struktur og funksjon har blitt fremja av høgoppløselige teknikkar som röntgenkrystallografi og kryo-elektronmikroskopi, som har avdekt detaljerte innblikk i dei konformasjonelle endringane som ligg til grunn for deira motilitet. Desse funna har vært avgjerande for å forstå både grunnleggjande cellebiologi og den molekylære basisen for sjukdomar knytt til kinesin dysfunksjon, som visse nevrodegenerative forstyrringar og kreft. Leiande forskingsorganisasjonar, inkludert National Institutes of Health og European Molecular Biology Laboratory, fortsetter å undersøke de molekylære mekanismene til kinesin motorproteiner, som understrekar deira grunnleggjande betydning i cellebiologi.
ATP Hydrolyse og Energiomforming
Kinesin motorproteiner er særs viktige molekylære maskiner som omformar kjemisk energi til mekanisk arbeid, noko som gjer det mogleg å transportere ulike cellulære frakt langs mikrotubuli. Den grunnleggjande prosessen som ligg til grunn for denne rørsla er hydrolysen av adenosintrifosfat (ATP), som gir energien som er nødvendig for kinesins konformasjonelle endringar og retning.
ATP-hydrolyse skjer ved motorområda (også kalla «hovud») av kinesin-dimeren. Kvar hovud inneheld ein høgt bevart nukleotid-bindingssete som vekselsvis bind og hydrolyserer ATP. Dei mekanokjemiske syklane begynner når eine kinesin-hovudet, tett bunde til mikrotubuli, bind ATP. Denne bindinga induserer ei konformasjonell endring i nakkelinkarregionen, som skyver det etterfølgjande hovudet framover i ein «hand-over-hand» rørsle. Når det førebyggjande hovudet binder seg til den neste tubulin-underenheten, hydrolyseres ATP til adenosindifosfat (ADP) og uorganisk fosfat (Pi), og frigjer energi som blir omforma til mekanisk rørsle. Frigjering av Pi og påfølgjande bytte av ADP mot ATP resetter syklusen, og gjer mogleg for kontinuerlig prosessiv rørsle langs mikrotubuli.
Effektiviteten av energiomforming i kinesin er bemerkelsesverdig. Kvar ATP-molekyl som hydrolyseres resulterer i ein 8-nanometer steg langs mikrotubuli, med minimal energitap. Denne høge effektiviteten kan tilskrivast tett kopling mellom ATP-hydrolyse og den mekaniske steppemekanismen. Prosessen er høgt regulert, og sikrar at ATP-hydrolyse berre skjer når kinesin-hovudet er korrekt engasjert med mikrotubuli, og dermed forhindrar bortkastning av energi.
Kinesins ATPase aktivitet blir også moduler av tilstedeværelsen av frakt og den spesifikke kinesin-familien involvert. For eksempel, konvensjonell kinesin-1 er høgt prosessiv, kapabel til å ta hundrevis av steg utan å dissosiere frå mikrotubuli, medan andre kinesin-familie medlemmer kan ha ulike ATP-hydrolyse hastigheiter og steppemåtar, tilpassa deira cellulære funksjonar.
Studien av ATP-hydrolyse og energiomforming i kinesin har vært sentral for å forstå intracellulære transportmekanismar og dei breire prinsippa for molekylære motorfunksjonar. Forskning på dette området får støtte fra leiande vitenskaplege organisasjoner som National Institutes of Health og National Science Foundation, som finansierer undersøkingar på strukturell biologi og biofysikk av motorproteiner. Innsikt oppnådd fra desse studiene har implikasjonar for nevrobiologi, celledeling og utvikling av nanoteknologiske applikasjonar som etterlikner biologiske motorar.
Fraktgjenkjenning og Binding Spefifisitet
Kinesin motorproteiner er essensielle molekylære maskiner som transporterer ei rekkje intracellulære frakt langs mikrotubuli baner, og spelar ei avgjerande rolle i prosessar som posisjonering av organellar, vesikkeltrafikk og mitose. Spefifisiteten som kinesiner gjenkjenner og binder til frakten er grunnleggjande for nøyaktigheita og reguleringa av intracellulær transport. Denne spefifisiteten oppnås gjennom ein kombinasjon av strukturelle trekk, adaptorproteiner og regulatoriske mekanismar.
Kinesin-superfamilien er kjenneteikna av eit bevart motorområde ansvarleg for ATP-hydrolyse og mikrotubulibinding, men fraktgjenkjenning og binding-funksjonar blir primært formidla av de variable halebanda. Desse haleregionene varierer betydelig blant kinesin-familie medlemmene, og gjer det mogleg for selektiv interaksjon med ulike frakter. For eksempel brukar kinesin-1 (også kjent som konvensjonell kinesin) sitt C-terminal haleband for å binde til ei rekkje frakt, inkludert membranbundne organellar og vesiklar, ofte via adaptorproteiner som kinesin light chains (KLCs). KLCs inneheld tetratrikopeptid-repeatar (TPR) motiv som lettar gjenkjenning av spesifikke frakt-assosierte protein, og gjer dermed selektivitet til transportprosessen.
Adaptorproteiner spelar ei avgjerande rolle i å knyte kinesiner til frakten. Desse adaptorane kan gjenkjenne spesifikke signal eller motiv på overflata av frakten, og sikrar at berre korrekt frakt blir transportert av ein gitt kinesin. For eksempel er interaksjonen mellom KLCs og JIP (c-Jun N-terminal kinase-interagerande protein) familimedlemmer godt dokumentert i nevrale transport, der JIPs fungerer som stillasar som knyter kinesin-1 til vesiklar som inneheld signalmolekyl. Andre kinesinfamilie-medlemmer, som kinesin-3, brukar ulike adaptorar og halebandstrukturar for å oppnå fraktspefifisitet, noko som reflekterer variasjonen av frakter og cellulære kontekstar der kinesiner opererer.
Reguleringa av fraktbinding oppnås også gjennom post-translasjonelle modifikasjonar og konkurrerande interaksjonar. Fosforylering av kinesinhaler eller adaptorproteiner kan modulere bindingseffektiviteten, og gjere dynamisk kontroll over fraktvedheft og frigjering i respons til cellulære signal. I tillegg kan nokre frakter konkurrere om binding til same kinesin, og innføre ei anna reguleringslag som sikrar korrekt fraktfordeling.
Studien av fraktgjenkjenning og binding spefifisitet i kinesin motorproteiner er eit raskt utviklande felt, med implikasjonar for å forstå nevrodegenerative sjukdomar, intracellulære trafikkforstyrringar og utvikling av målretta terapier. Leiande forskingsorganisasjoner som National Institutes of Health og European Molecular Biology Organization støttar pågåande undersøkingar på dei molekylære mekanismane som ligg til grunn for kinesin-frakt interaksjonar, og understrekar den biomedisinske betydninga av dette området.
Intracellulære Transportvegar
Kinesin motorproteiner er essensielle molekylære maskiner som driv intracellulær transport langs mikrotubuli baner, og sikrar presis levering av organellar, vesiklar, protein og andre frakter i eukaryote celler. Desse ATP-avhengige motorane er kjenneteikna av evna til å omforme kjemisk energi til mekanisk arbeid, og let bevegelse av cellulære komponentar over lange avstandar med bemerkelsesverdig retning og spesifisitet.
Strukturelt består kinesiner typisk av to tunge kjeder som dannar ein dimer, kvar med eit globulært motorområde (hovud) som binder seg til mikrotubuli og hydrolyserer ATP. Halebanda er ansvarlege for fraktgjenkjenning og binding, ofte i tilknytting med lette kjeder eller adaptorproteiner. Den mest vel-studerte medlemmen, kinesin-1, rører seg overvektig mot plussenden av mikrotubuli, som generelt svarer til celleperiferien, og spelar dermed ei avgjerande rolle i anterograd transport.
Mekanismen for kinesins rørsle blir ofte beskriven som ein «hand-over-hand» gåande rørsle, der dei to motorområda vekselsvis bind seg til og steppar langs mikrotubuli gitteret. Kvar steg er tett knytt til hydrolysen av ein enkelt ATP-molekyl, noko som sikrar prosessivitet og retning. Denne koordinerte rørsla gjer at kinesiner kan transportere frakt over avstandar som kan spenne heile lengda av ein nevron eller andre store celletypar.
Kinesiner blir klassifiserte i fleire familier basert på sekvenshomologi og funksjonell spesialisering. Mens kinesin-1 er primært involvert i transport av organellar og vesiklar, har andre familier som kinesin-2 og kinesin-3 distinkte roller i cilie transport og synaptisk vesikkel transportering, respektivt. Nokre kinesiner, som kinesin-5, er involverte i mitotiske spindle dynamikk snarare enn frakttransport, noko som fremhever den funksjonelle variasjonen innan denne protein superfamilien.
Aktiviteten til kinesinmotorar blir tett regulert av cellulære signalvegar, post-translasjonelle modifikasjonar, og interaksjonar med mikrotubuli-assosierte protein. Denne reguleringa sikrar at frakter blir levert til dei rette subcellulære stadene i respons til fysiologiske behov. Forstyrring av kinesin-mediert transport har blitt knytt til ulike sjukdomar, inkludert nevrodegenerative forstyrringar, der defekt axonal transport bidrar til nevron dysfunksjon og degenerasjon.
Forskning på kinesin motorproteiner fortsetter å fremja vår forståing av cellulær logistikk og har inspirert utviklinga av biomimetiske nanovitar. Leiande vitenskapelige organisasjoner som National Institutes of Health og Nature Publishing Group publiserer regelmessig grunnleggjande studiar og anmeldelser om strukturen, funksjonen og biomedisinsk betydning av kinesinmotorar, som understreker deira sentrale rolle i cellebiologi.
Regulering av Kinesin Aktivitet
Kinesin motorproteiner er essensielle molekylære maskiner som transporterer frakt langs mikrotubuli innan eukaryote celler. Reguleringa av kinesinaktivitet er avgjerande for å oppretthalde cellulær organisering, sikre riktig distribusjon av organellar, og støtte prosessar som mitose og nevral funksjon. Fleire lag av regulering eksisterer for å kontrollere når, kvar, og korleis kinesiner interagerer med frakta og mikrotubuli baner.
Ein primær mekanisme for regulering er gjennom autoinhibisjon. Mange kinesinfamilie medlemmer, slik som kinesin-1, har haleband som kan bretta seg tilbake og interagere med motorområda sine, og forhindrar ATPase aktivitet og mikrotubuli binding i fravær av frakt. Denne autoinhiberte konformasjonen blir lettet ved fraktbinding, som induserer ei konformasjonell endring som aktiverer motoren for prosessiv bevegelse. Denne mekanismen sikrar at kinesiner berre er aktive når dei trengs, og forhindrar unødvendig ATP-forbruk og mogleg cellulær skade.
Post-translasjonelle modifikasjonar (PTMs) spelar også ei viktig rolle i modulering av kinesinaktivitet. Fosforylering er den mest omfattende studerte PTM-en, med kinasar som syklindependerte kinasar (CDKs) og glykogen syntase kinase 3 (GSK3) som fosforylerar spesifikke rester på kinesinproteiner. Desse modifikasjonane kan både auke eller hemme motoraktiviteten, avhengig av konteksten og den spesifikke kinesinen som er involvert. For eksempel, fosforylering av kinesin-1 av GSK3 hemmer evna til å binde seg til mikrotubuli, og regulerer dermed axonal transport i nevron.
Frakt-adaptorproteiner finjusterer vidare kinesinreguleringa. Desse adaptorane, som JIP1 og Milton, knyt kinesiner til spesifikke frakt og kan modulere motoraktiviteten ved å stabilisere den aktive konformasjonen eller rekruttere tilleggsregulatoriske faktorar. Samspillet mellom adaptorar og motorar gjer det mogleg for presis romleg og tidsmessig kontroll av fraktlevering, noko som er spesielt kritisk i høgt polariserte celler som nevron.
I tillegg kan mikrotubuli banene sjølv påverke kinesinaktivitet. Mikrotubuli-assosierte protein (MAPs) og tubulin post-translasjonelle modifikasjonar (som acetylasjon eller detyrosinering) kan endre bindingseffektivitet og motilitet av kinesiner, og effektivt guide eller begrense deira rørsle langs spesifikke mikrotubuli subset.
Reguleringa av kinesin motorproteiner er eit tema for pågåande forskning, med implikasjonar for å forstå nevrodegenerative sjukdomar, kreft, og utviklingsforstyrringar. Leiande organisasjoner som National Institutes of Health og Nature Publishing Group støtter og distribuerer forskning på dette feltet, og understreker viktigheten av kinesinregulering i helse og sjukdom.
Kinesin i Nevrale Funksjonar og Axonal Transport
Kinesin motorproteiner er ein superfamilie av ATP-avhengige molekylære motorar som spelar ei avgjerande rolle i intracellulær transport, spesielt innan det høgt polariserte miljøet av nevron. Desse protein rører seg langs mikrotubuli baner, og omformar kjemisk energi frå ATP-hydrolyse til mekanisk arbeid, som gjer mogleg for den retta bevegelsen av ulike cellulære frakt. I nevron er kinesiner essensielle for transporten av organellar, synaptisk vesikkel forløparar, protein og mRNA frå cellekroppen (soma) til aksonterminalen, ein prosess kjend som anterograd axonal transport.
Kinesin-superfamilien er variert, med over 40 forskjellige kinesin gener identifisert hos menneske, kvar av dei kodar for protein med spesialiserte funksjonar og fraktspefifisitetar. Den mest velkarakteriserte medlemmen, kinesin-1 (også kjent som konvensjonell kinesin), er ei heterotetramer som består av to tunge kjeder og to lette kjeder. Dei tunge kjedene inneheld motorområda ansvarlege for ATP-hydrolyse og mikrotubuli binding, medan de lette kjedene medierer fraktgjenkjenning og binding. Denne strukturelle organisasjonen gjer at kinesin-1 kan transportere ei rekkje frakter som er kritisk for nevral funksjon og overleving.
Axonal transport er avgjerande for å oppretthalde nevron helse og funksjon, med tanke på den ekstreme lengda av nokre aksoner, som kan strekke seg opp til ein meter hos menneske. Kinesin-dreven anterograd transport sikrar rettidig levering av synaptiske komponentar, mitokondriar og andre essensielle organellar til fjerne område av nevron. Forstyrring av kinesinfunksjon kan føre til manglar i synaptisk transmisjon, aksonal degenerasjon, og har blitt knytt til fleire nevrodegenerative sjukdomar, inkludert Alzheimer sin sjukdom og amyotrofisk lateral sklerose (ALS). Viktigheten av kinesin-mediert transport i nevron helse styrkes av forskning frå leiande vitenskaplege organisasjoner som National Institutes of Health og National Institute of Neurological Disorders and Stroke, som har framheva sambandet mellom axonal transportfeil og nevrodegenerasjon.
I tillegg til anterograd transport, koordinerer kinesiner også med dynein motorproteiner, som medierer retrograd transport (frå aksonterminalen tilbake til soma), for å oppretthalde den tosidige flyten av materiale som er nødvendig for nevral homeostase. Den presise reguleringa av kinesinaktivitet, fraktval, og koordinering med andre motorproteiner er eit tema for pågåande forskning, med implikasjonar for å forstå den molekylære basisen for nevral tilkopling, plastisitet, og sjukdom.
Samanliknande Analyse: Kinesin vs. Dynein og Myosin
Kinesin motorproteiner er ein grunnleggjande klasse av molekylære motorar som spelar ei kritisk rolle i intracellulær transport, spesielt langs mikrotubuli baner. For å fullt ut forstå deira biologiske betydning, er det essensielt å samanlikne kinesiner med dei andre to hovudfamiliane av cytoskeletal motorproteiner: dyneins og myosins. Kvar av desse motorprotein er spesialiserte for bevegelse langs distinkte cytoskeletal filamenter, og er tilpassa spesifikke cellulære funksjonar.
Kinesiner og dyneiner krysser begge mikrotubuli, men dei skil seg i retning og fraktspefifisitet. Kinesiner rører seg vanligvis mot plussenden av mikrotubuli, som typisk er orientert mot celleperiferien, og legg til rette for anterograd transport av organellar, vesiklar, og protein-kompleks. I motsetning til dette rører dyneiner seg mot minusenden av mikrotubuli, og leier frakt mot cellemidten, som kjernen eller mikrotubuli organiserande senter. Dette tosidige systemet sikrar effektiv distribusjon og resirkulering av cellulære komponentar. Strukturelt er kinesiner typisk homodimeriske eller heterodimeriske protein med to motorområder, mens cytoplasmiske dyneiner er store, fleire-underenheter komplekser med ein meir intrikat mekanisme for kraftgenerering og regulering (National Institute of Genetics).
Myosiner, på den andre sidan, er primært aktin-baserte motorproteiner. Dei er best kjente for deira rolle i muskelkontraksjon, men dei deltar også i ein rekke ikkje-muskel cellulære prosessar, som cytokinese, vesikkeltransport og cellemotilitet. I motsetning til kinesiner og dyneiner, som rører seg langs mikrotubuli, passerer myosiner aktinfilamenter, vanligvis mot pluss (barbed) enden. Den strukturelle organisasjonen av myosiner er distinkt, med eit karakteristisk hovudområde som binder aktin og hydrolyserer ATP, ein nakke-region, og ein hale som determinere fraktspefifisitet (National Institutes of Health).
Funksjonelt er dei tre motorproteinfamiliene tilpassa deira respektive cytoskeletal spor og cellulære roller. Kinesiner er avgjerande for langvegs, retningsbestemt transport i nevron og delande celler, mens dyneiner er essensielle for retrograd transport og cilie/flagella bevegelse. Myosiner, på den andre sida, er sentrale i prosessar som krev kraftgenerering og kortvegs transport på aktin-nettverk. Samspillet mellom desse motorane sikrar den dynamiske organisasjonen og tilpassbarheita til den eukaryote cella.
Kort sagt, mens kinesiner, dyneiner, og myosiner deler den grunnleggjande eigenskapen med å omforme kjemisk energi frå ATP-hydrolyse til mekanisk arbeid, er dei spesialisert for ulike spor, retningar, og cellulære funksjonar. Deira koordinerte handlingar er vitale for å oppretthalde cellulær arkitektur, signalering, og homeostase.
Kinesin-Relaterte Sjukdomar og Terapeutiske Mål
Kinesin motorproteiner er essensielle molekylære maskiner som transporterer ulike cellulære frakter langs mikrotubuli, og spelar ei avgjerande rolle i intracellulær trafikk, mitose, og nevral funksjon. Dysregulering eller mutasjon av kinesin gener har blitt knytt til eit spektrum av menneskesjukdomar, noko som gjer desse proteinane viktige både som biomarkørar og som potensielle terapeutiske mål.
Eit av dei mest dokumenterte sjukdomsforholdene involverer kinesinfamilie medlemmet KIF1A. Mutasjonar i KIF1A genet er knytt til eit spektrum av nevrodegenerative forstyrringar, samla kalla KIF1A-forbundet nevrologisk forstyrring (KAND). Desse tilstandene viser seg som intellektuell funksjonshemming, spastisk paraplegi, og progressiv nevrodegenerasjon. Den underliggjande patologien blir ofte tilskriven svekking av axonal transport, som forstyrrer synaptisk funksjon og nevron overleving. På same tid, mutasjonar i andre kinesin gener, som KIF5A og KIF21A, er knytt til arvelig spastisk paraplegi og kongenitt fibrose av de ekstraokulære musklene, respektivt, og understreker den kritiske rollen til kinesiner i helse i nervesystemet.
Utover nevrodegenerasjon er kinesin motorproteiner også impliserte i kreft. For eksempel er KIF11 (også kjent som Eg5) essensiell for mitotisk spindle danning under celledeling. Overuttrykk eller hyperaktivitet av KIF11 har blitt observert i ulike kreftformer, inkludert brystkreft og prostatakreft, der det bidrar til ukontrollert celledeling. Som eit resultat har KIF11 blitt eit lovande mål for anti-mitotiske kreftterapier. Fleire små molekylhemmerar av KIF11, som ispinesib, har gått inn i kliniske studiar, med mål om å selektere forstyrre deling av kreftceller mens dei sparer normale celler. Utviklinga og evalueringa av desse hemmerane blir nøye overvaka av regulerte og forskingsorganisasjoner som National Cancer Institute og den amerikanske Food and Drug Administration.
Terapeutiske strategiar som målretta kinesin motorproteiner strekker seg utover onkologi. I nevrodegenerative sjukdomar er det arbeid på gang for å utvikle molekyl som kan gjenskape eller modulerer kinesinfunksjonen, som potensielt kan mildne aksjonal transport mangel. I tillegg utforskar forskning støtta av organisasjoner som National Institutes of Health genterapi og småmolekylære tilnærmingar for å korrigere eller kompensera for defekte kinesinaktivitet i genetiske forstyrringar.
For å oppsummere er kinesin motorproteiner sentrale for cellulær helse, og deira dysfunksjon er knytt til eit mangfald av sjukdomar, spesielt i nervesystemet og i kreft. Pågåande forskning og kliniske utviklingsinnsats fortsetter å utforske kinesiner som både biomarkørar og terapeutiske mål, med potensiale for å gi nye behandlingar for for tida ubehandlarleg tilstandar.
Ny Forskning og Framtidige Retningar
Ny forskning på kinesin motorproteiner er raskt i utvikling og utvidar vår forståing av deira roller i cellulære prosessar og deira potensielle applikasjonar i bioteknologi og medisin. Kinesiner er ein superfamilie av ATP-avhengige molekylære motorar som transporterer frakts langs mikrotubuli, og spelar essensielle roller i intracellulær trafikk, mitose, og nevral funksjon. Nylige framsteg i høgoppløysande avbilding og enkeltmolekyl biophysikk har gjort det mogleg for forskarar å visualisere kinesin-dynamikk i uvanleg detalj, og avdekke nye innsikter i deira mekanokjemiske syklar og regulatoriske mekanismar.
Ei lovande retning involverer utrekning av kinesins strukturelle variasjon og implikasjonar for fraktspefifisitet og regulering. Strukturelle biologi teknikkar, som kryo-elektronmikroskopi, har avdekt distinkte konformasjonelle tilstandar av kinesinfamilie medlemmar, noko som antydar spesialiserte tilpassingar for ulike cellulære oppgåver. Denne strukturelle kunnskapen informerer utforminga av små molekyl og peptid som kan modulere kinesinaktivitet, med potensielle terapeutiske applikasjonar i nevrodegenerative sjukdomar og kreft, der avvikande kinesinfunksjon er knytt til patogenese.
Syntetisk biologi utnyttar også kinesinmotorar til å konstruere transportsystem i nanoskala. Ved å utnytte den retningsbestemte bevegelsen til kinesiner, utviklar forskarar biomimetiske enheiter for målretta legemiddellevering og molekylær samling. Desse innovasjonane kan revolusjonere presisjonsmedisin ved å gjere det mogleg for kontrollert transport av terapeutiske middel innan celler eller vev.
Eit anna ny emerging område er studien av kinesins rolle i nevral helse og sjukdom. Mutasjonar i kinesin gener har blitt knytt til arvelig spastisk paraplegi, Charcot-Marie-Tooth sjukdom, og andre nevrodegenerative forstyrringar. Pågåande forskning har som mål å klargjere korleis desse mutasjonane forstyrrer aksjontransport og å identifisere strategiar for å gjenskape normal funksjon. National Institutes of Health og National Institute of Neurological Disorders and Stroke støttar initiativ for å undersøke de molekylære fundamenta for desse sjukdomane og utvikle målretta intervensjonar.
Ser vi framover, vil integreringa av datamodellering, avansert mikroskopi, og genredigeringsteknologiar forvente å akselerere oppdagingar innan kinesinbiologi. Samarbeid mellom akademiske institusjonar, myndigheitsorgan, og bioteknologiske selskap fremmer oversettinga av grunnforsking til kliniske og industrielle applikasjonar. Ettersom vår forståing av kinesin motorproteiner djupar, vil nye moglegheiter oppstå for å manipulere intracellulær transport, diagnostisere sjukdom, og designe innovative terapeutiske strategiar.
Kjelder & Referansar
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute