Białka motorowe kinesyny: dynamiczne silniki napędzające logistykę wewnątrzkomórkową. Odkryj, jak te maszyny molekularne rewolucjonizują funkcjonowanie i zdrowie komórek.
- Wprowadzenie do białek motorowych kinesyny
- Struktura molekularna i mechanizm działania
- Hydroliza ATP i konwersja energii
- Rozpoznawanie ładunków i specyficzność wiązania
- Wejściowe szlaki transportowe
- Regulacja aktywności kinesyn
- Kinesyna w funkcjonowaniu neuronów i transporcie aksonalnym
- Analiza porównawcza: Kinesyna vs. Dyneina i Miozyna
- Choroby związane z kinesynami i cele terapeutyczne
- Nowe badania i przyszłe kierunki
- Źródła i odniesienia
Wprowadzenie do białek motorowych kinesyny
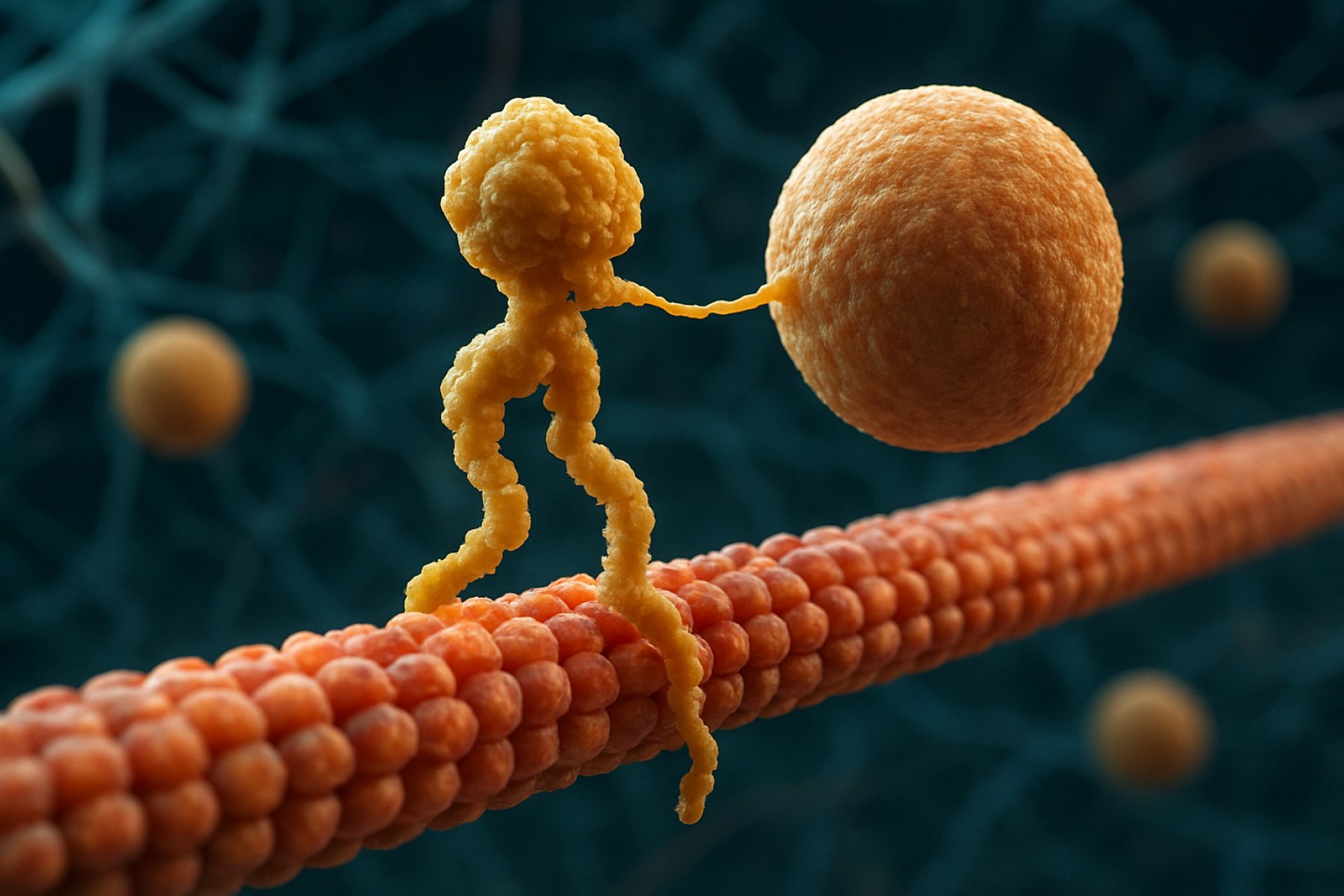
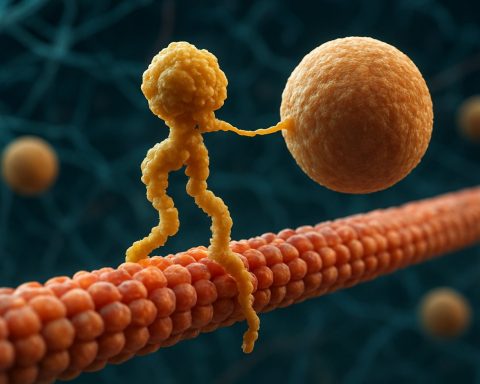
Białka motorowe kinesyny to podstawowa klasa molekularnych silników odgrywających kluczową rolę w transporcie wewnątrzkomórkowym i organizacji komórkowej. Odkryte w połowie lat 80., kinesyny to białka zależne od ATP, które poruszają się wzdłuż mikrotubul w komórkach eukariotycznych, transportując różnorodne ładunki, takie jak organelle, pęcherzyki, białka i mRNA. Ten transport jest niezbędny dla wielu procesów komórkowych, w tym mitozy, mejozy i funkcjonowania neuronów. Superrodzina kinesyn jest duża i różnorodna, zidentyfikowano ponad 40 różnych genów kinesyn u ludzi, z których każdy koduje białka o specjalizowanych funkcjach i specyficzności ładunków.
Strukturalnie, kinesyny składają się zazwyczaj z dwóch łańcuchów ciężkich i dwóch łańcuchów lekkich. Łańcuchy ciężkie zawierają zachowaną domenę motorową, która wiąże się z mikrotubulami i hydrolizuje ATP, generując ruch. Domena ogonowa kinesyn odpowiada za wiązanie ładunków, umożliwiając motorom transportowanie specyficznych komponentów komórkowych do ich zamierzonych miejsc docelowych. Ruch kinesyny jest zazwyczaj skierowany w stronę dodatniego końca mikrotubul, co zazwyczaj odpowiada peryferiom komórki, chociaż niektóre członkowie rodziny kinesyn poruszają się w stronę końca ujemnego.
Mechanizm ruchu kinesyn opisywany jest często jako „ruch ręka nad ręką”, gdzie dwie domeny motorowe naprzemiennie wiążą się i uwalniają mikrotubulę, co jest napędzane cyklami wiązania i hydrolizy ATP. Ten procesywny ruch pozwala kinesynom na podróżowanie na długich dystansach wzdłuż mikrotubul bez odczepiania się, czyniąc je wysoce efektywnymi transporterami w zatłoczonej przestrzeni komórkowej. Precyzyjna regulacja aktywności kinesyn jest kluczowa dla utrzymania homeostazy i funkcji komórkowej.
Białka motorowe kinesyny są nie tylko niezbędne dla normalnych operacji komórkowych, ale również wiążą się z różnymi chorobami. Defekty w funkcji kinesyn zostały powiązane z zaburzeniami neurodegeneracyjnymi, takimi jak choroba Alzheimera i dziedziczna spastyczna paraplegia, a także niektórymi nowotworami. W związku z tym, kinesyny są przedmiotem intensywnych badań, zarówno w celu zrozumienia ich podstawowej biologii, jak i w celu zbadania ich potencjału jako cele terapeutyczne.
Badania nad białkami motorowymi kinesyn wspierane są i rozwijane przez wiodące organizacje naukowe i instytuty badawcze na całym świecie, w tym National Institutes of Health oraz Nature Publishing Group, które regularnie publikują recenzowane badania nad strukturą, funkcją i znaczeniem biomedycznym tych białek. Kontynuowe badania nad kinesynami ujawniają nowe wnioski na temat molekularnej maszyny życia i oferują obiecujące możliwości opracowywania nowych interwencji medycznych.
Struktura molekularna i mechanizm działania
Białka motorowe kinesyny to superrodzina zależnych od ATP molekularnych silników, które odgrywają kluczową rolę w transporcie wewnątrzkomórkowym, szczególnie wzdłuż mikrotubul. Strukturalnie, kinesyny składają się zazwyczaj z dwóch łańcuchów ciężkich i dwóch łańcuchów lekkich, tworząc heterotetrameryczny kompleks. Łańcuchy ciężkie zawierają wysoce zachowaną domenę motorową (nazywaną również „głową”), spiralną łodygę oraz domenę ogonową na końcu C. Domena motorowa odpowiada za wiązanie z mikrotubulami i hydrolizę ATP, co zapewnia energię niezbędną do ruchu. Domena ogonowa, w przeciwieństwie do tego, bierze udział w rozpoznawaniu i wiązaniu ładunków, często interagując z białkami adaptorowymi lub bezpośrednio z pęcherzykami i organellami.
Mechanizm działania białek motorowych kinesyny opisywany jest zazwyczaj jako „ruch ręka nad ręką”. Każda cząsteczka kinesyny ma dwie domeny motorowe, które naprzemiennie wiążą się z mikrotubulą i uwalniają z niej, koordynowane przez wiązanie i hydrolizę ATP. Kiedy jedna głowa wiąże się z mikrotubulą i hydrolizuje ATP, przechodzi zmianę konformacyjną, która popycha drugą głowę do przodu w stronę następnego miejsca wiązania, oddalonego o około 8 nanometrów. Proces ten się powtarza, umożliwiając kinesynie „chodzenie” w jednym kierunku wzdłuż mikrotubuli, zazwyczaj w stronę dodatniego końca, co jest skierowane w stronę peryferii komórkowej. Skoordynowane działanie obu głów zapewnia procesywność, co oznacza, że kinesyna może wykonać wiele kroków wzdłuż mikrotubuli bez dezintegracji, co jest niezbędne dla efektywnego transportu ładunków na długich dystansach wewnątrz komórki.
Kinesyny są bardzo zróżnicowane, z ponad 40 różnymi genami kinesyn zidentyfikowanymi u ludzi, z których każdy jest dostosowany do specyficznych funkcji komórkowych. Podczas gdy większość kinesyn porusza się w stronę dodatniego końca mikrotubuli, niektóre, takie jak członkowie rodziny kinesyn-14, poruszają się w stronę końca ujemnego, co podkreśla funkcjonalną wszechstronność tej rodziny białek. Aktywność i kierunkowość kinesyn są determinowane subtelnymi różnicami w ich domenach motorowych i związanych regionach regulacyjnych.
Badania nad strukturą i funkcją kinesyn postępują dzięki technikom o wysokiej rozdzielczości, takim jak krystalografia rentgenowska i kriokomikroskopia elektronowa, które ujawniają szczegółowe wglądy w zmiany konformacyjne, które leżą u podstaw ich ruchliwości. Te odkrycia miały kluczowe znaczenie dla zrozumienia nie tylko podstawowej biologii komórkowej, ale także molekularnych podstaw chorób powiązanych z dysfunkcją kinesyn, takich jak niektóre zaburzenia neurodegeneracyjne i nowotwory. Wiodące organizacje badawcze, w tym National Institutes of Health i European Molecular Biology Laboratory, kontynuują badania nad molekularnymi mechanizmami białek motorowych kinesyny, podkreślając ich fundamentalne znaczenie w biologii komórkowej.
Hydroliza ATP i konwersja energii
Białka motorowe kinesyny to niezbędne molekularne maszyny, które konwertują energię chemiczną na pracę mechaniczną, umożliwiając transport różnych ładunków komórkowych wzdłuż mikrotubul. Podstawowym procesem leżącym u podstaw tego ruchu jest hydroliza adenozynotrójfosforanu (ATP), która dostarcza energię niezbędną do zmian konformacyjnych kinesyn i ich kierunkowego ruchu.
Hydroliza ATP zachodzi w domenach motorowych (nazywanych również „główkami”) dimery kinesyn. Każda głowa posiada wysoce zachowane miejsce wiązania nukleotydów, które naprzemiennie wiąże i hydrolizuje ATP. Cykl mechanochemiczny rozpoczyna się, gdy jedna z głów kinesyny, ściśle związana z mikrotubulą, wiąże ATP. To wiązanie powoduje zmianę konformacyjną w regionie łącznika szyjki, co popycha tylną głowę do przodu w ruchu „ręka nad ręką”. Kiedy wiodąca głowa wiąże się z następnym podjednostką tubuliny, ATP jest hydrolizowane do adenozynodifosforanu (ADP) i fosforanu nieorganicznego (Pi), uwalniając energię, która jest przekształcana w ruch mechaniczny. Uwolnienie Pi i następna wymiana ADP na ATP resetują cykl, pozwalając na ciągły procesywny ruch wzdłuż mikrotubuli.
Efektywność konwersji energii w kinesynach jest niezwykła. Każda cząsteczka ATP, która jest hydrolizowana, skutkuje krokiem o długości 8 nanometrów wzdłuż mikrotubuli, przy minimalnych stratach energii. Ta wysoka efektywność jest przypisywana ścisłemu sprzężeniu pomiędzy hydrolizą ATP a mechanicznym mechanizmem krokowym. Proces jest ściśle regulowany, zapewniając, że hydroliza ATP zachodzi tylko wtedy, gdy głowa kinesyny jest odpowiednio zaangażowana w mikrotubulę, zapobiegając tym samym niepotrzebnemu wydatkowaniu energii.
Aktywność ATPazowa kinesyn jest również modyfikowana przez obecność ładunku i specyficzny typ członka rodziny kinesyn. Na przykład, konwencjonalna kinesyna-1 jest bardzo procesywna, zdolna do wykonywania setek kroków bez odczepiania się od mikrotubuli, podczas gdy inne członkowie rodziny kinesyn mogą mieć różne wskaźniki hydrolizy ATP i zachowania krokowe, dostosowane do ich funkcji komórkowych.
Badania nad hydrolizą ATP i konwersją energii w kinesynach miały kluczowe znaczenie dla zrozumienia mechanizmów transportu wewnątrzkomórkowego oraz szerszych zasad funkcji molekularnych motorów. Badania w tej dziedzinie są wspierane przez wiodące organizacje naukowe, takie jak National Institutes of Health i National Science Foundation, które finansują badania nad biologią strukturalną i biofizyką białek motorowych. Wnioski uzyskane z tych badań mają implikacje dla neurobiologii, podziału komórkowego i rozwoju zastosowań nanotechnologicznych, które naśladują molekularne silniki.
Rozpoznawanie ładunków i specyficzność wiązania
Białka motorowe kinesyny to podstawowe molekularne maszyny, które transportują różnorodne ładunki wewnątrzkomórkowe wzdłuż mikrotubul, odgrywając kluczową rolę w procesach takich jak pozycjonowanie organelli, transport pęcherzyków i mitozę. Specyfika, z jaką kinesyny rozpoznają i wiążą swoje ładunki, jest fundamentalna dla wierności i regulacji transportu wewnątrzkomórkowego. Ta specyficzność jest osiągana dzięki kombinacji cech strukturalnych, białek adaptorowych i mechanizmów regulacyjnych.
Superrodzina kinesyn charakteryzuje się zachowaną domeną motorową odpowiedzialną za hydrolizę ATP i wiązanie mikrotubul, ale funkcje rozpoznawania i wiązania ładunków są głównie pośredniczone przez zmienne domeny ogonowe. Te regiony ogonowe różnią się znacząco między członkami rodziny kinesyn, co pozwala na selektywne interakcje z różnymi ładunkami. Na przykład, kinesyna-1 (znana również jako konwencjonalna kinesyna) wykorzystuje swoją ogonową domenę C, aby wiązać różnorodne ładunki, w tym organelle związane z błoną oraz pęcherzyki, często przez białka adaptorowe takie jak lekkie łańcuchy kinesyn (KLC). KLC zawierają motywy tetratrikopetydowe (TPR), które ułatwiają rozpoznawanie specyficznych białek związanych z ładunkiem, co nadaje specyficzność procesowi transportu.
Białka adaptorowe odgrywają kluczową rolę w łączeniu kinesyn z ich ładunkami. Te adaptory mogą rozpoznawać specyficzne sygnały lub motywy na powierzchni ładunku, zapewniając, że tylko odpowiedni ładunek jest transportowany przez daną kinesyn. Na przykład, interakcja między KLC a członkami rodziny JIP (białka interakcyjne z kinazą c-Jun N-terminalną) jest dobrze udokumentowana w transporcie neuronalnym, gdzie JIP pełnią rolę rusztowania, łącząc kinesyn-1 z pęcherzykami zawierającymi cząsteczki sygnałowe. Inni członkowie rodziny kinesyn, tacy jak kinesyna-3, wykorzystują różne adaptory i struktury domen ogonowych, aby osiągnąć specyfikę ładunku, co odzwierciedla różnorodność ładunków i kontekstów komórkowych, w których działają kinesyny.
Regulacja wiązania ładunków jest również osiągana przez modyfikacje potranslacyjne i interakcje konkurencyjne. Fosforylacja ogonów kinesyn lub białek adaptorowych może modulować powinowactwo wiązania, umożliwiając dynamiczną kontrolę nad przyczepnościami ładunków w odpowiedzi na sygnały komórkowe. Dodatkowo, niektóre ładunki mogą konkurować o wiązanie z tą samą kinesyną, wprowadzając dodatkową warstwę regulacyjną, która zapewnia właściwe rozmieszczenie ładunków.
Badania nad rozpoznawaniem ładunków i specyfiką wiązania w białkach motorowych kinesyny to szybko rozwijająca się dziedzina, z implikacjami dla zrozumienia chorób neurodegeneracyjnych, zaburzeń transportu wewnątrzkomórkowego oraz rozwoju ukierunkowanych terapii. Wiodące organizacje badawcze, takie jak National Institutes of Health oraz European Molecular Biology Organization, wspierają trwające badania nad molekularnymi mechanizmami interakcji kinesyn-ładunek, podkreślając znaczenie biomedyczne tej dziedziny.
Wejściowe szlaki transportowe
Białka motorowe kinesyny to niezbędne molekularne maszyny, które napędzają transport wewnątrzkomórkowy wzdłuż mikrotubul, zapewniając precyzyjne dostarczanie organelli, pęcherzyków, białek i innych ładunków wewnątrz komórek eukariotycznych. Te zależne od ATP motory charakteryzują się zdolnością do konwertowania energii chemicznej na pracę mechaniczną, co ułatwia ruch komponentów komórkowych na dużych odległościach z niezwykłą kierunkowością i specyfiką.
Strukturalnie, kinesyny zwykle składają się z dwóch łańcuchów ciężkich tworzących dimer, z każdym mającym globularną domenę motorową (głowę), która wiąże się z mikrotubulami i hydrolizuje ATP. Domena ogonowa odpowiada za rozpoznawanie i wiązanie ładunków, często w związku z lekkimi łańcuchami lub białkami adaptorowymi. Najlepiej zbadanym członkiem, kinesyną-1, porusza się głównie w kierunku dodatniego końca mikrotubul, co zazwyczaj odpowiada peryferiom komórkowym, odgrywając tym samym kluczową rolę w transporcie anterogradowym.
Mechanizm ruchu kinesyn często opisywany jest jako „ruch ręka nad ręką”, gdzie dwie domeny motorowe naprzemiennie wiążą się i przesuwają wzdłuż sieci mikrotubul. Każdy krok jest ściśle powiązany z hydrolizą jednej cząsteczki ATP, co zapewnia procesywność i kierunkowość. To skoordynowane ruchy pozwalają kinesynom transportować ładunki na odległości, które mogą pokrywać całą długość neuronu lub innych dużych typów komórek.
Kinesyny klasyfikowane są w wiele rodzin na podstawie homologii sekwencji i specjalizacji funkcjonalnej. Podczas gdy kinesyna-1 jest głównie zaangażowana w transport organelli i pęcherzyków, inne rodziny, takie jak kinesyna-2 i kinesyna-3, mają odmienne role w transporcie rzęskowym i transporcie pęcherzyków synaptycznych, odpowiednio. Niektóre kinesyny, takie jak kinesyna-5, są zaangażowane w dynamikę wrzeciona mitotycznego zamiast transportu ładunków, co podkreśla różnorodność funkcjonalną w tej superrodzinie białek.
Aktywność motorów kinesyn jest ściśle regulowana przez szlaki sygnalizacyjne komórki, modyfikacje potranslacyjne i interakcje z białkami związanymi z mikrotubulami. Ta regulacja zapewnia, że ładunki są dostarczane do odpowiednich lokalizacji subkomórkowych w odpowiedzi na potrzeby fizjologiczne. Zakłócenie transportu mediowanego przez kinesyny zostało powiązane z różnymi chorobami, w tym zaburzeniami neurodegeneracyjnymi, gdzie uszkodzony transport aksonalny przyczynia się do dysfunkcji i degeneracji neuronów.
Badania nad białkami motorowymi kinesynami nadal zwiększają naszą wiedzę na temat logistyki komórkowej i zainspirowały rozwój biomimetycznych nanurządzeń. Wiodące organizacje naukowe, takie jak National Institutes of Health oraz Nature Publishing Group regularnie publikują podstawowe badania i przeglądy dotyczące struktury, funkcji oraz znaczenia biomedycznego motorów kinesyn, podkreślając ich centralną роль w biologii komórkowej.
Regulacja aktywności kinesyny
Białka motorowe kinesyny to istotne molekularne maszyny, które transportują ładunki wzdłuż mikrotubuli wewnątrz komórek eukariotycznych. Regulacja aktywności kinesyna jest kluczowa dla utrzymania organizacji komórkowej, zapewnienia prawidłowego rozmieszczenia organelli oraz wspierania procesów takich jak mitoza i funkcjonowanie neuronów. Istnieje wiele warstw regulacji, aby kontrolować, kiedy, gdzie i jak kinesyny interakcjonują z ich ładunkami i szlakami mikrotubul.
Jednym z głównych mechanizmów regulacji jest autoinhibicja. Wiele członków rodziny kinesyn, takich jak kinesyna-1, posiada domeny ogonowe, które mogą się zginać i wchodzić w interakcje ze swoimi domenami motorowymi, zapobiegając aktywności ATPaz oraz wiązaniu mikrotubuli w przypadku braku ładunku. Ta autoinhibowana konformacja jest uwalniana po związaniu ładunku, co wywołuje zmianę konformacyjną, która aktywuje motor do procesu transportu. Ten mechanizm zapewnia, że kinesyny są aktywne tylko wtedy, gdy to konieczne, zapobiegając niepotrzebnej konsumpcji ATP i potencjalnym uszkodzeniom komórek.
Modyfikacje potranslacyjne (PTM) również odgrywają znaczącą rolę w modulowaniu aktywności kinesyny. Fosforylacja jest najczęściej badanym PTM, w którym kinazy takie jak kinazy zależne od cykliny (CDK) i kinaza glikogenowa 3 (GSK3) fosforylują specyficzne reszty w białkach kinesyn. Te modyfikacje mogą zarówno zwiększać, jak i hamować aktywność motorową, w zależności od kontekstu oraz konkretnej kinesyny. Na przykład, fosforylacja kinesyny-1 przez GSK3 hamuje jej zdolność do wiązania mikrotubuli, regulując tym samym transport aksonalny w neuronach.
Białka adaptorowe ładunku jeszcze bardziej precyzują regulację kinesyn. Te adaptory, takie jak JIP1 i Milton, łączą kinesyny z konkretnymi ładunkami i mogą modyfikować aktywność silnika, stabilizując aktywną konformację lub rekrutując dodatkowe czynniki regulacyjne. Współdziałanie adaptorów i motorów pozwala na precyzyjną kontrolę przestrzenną i czasową dostarczania ładunków, co jest szczególnie istotne w silnie spolaryzowanych komórkach, takich jak neurony.
Dodatkowo, same mikrotubule mogą wpływać na aktywność kinesyn. Białka związane z mikrotubulami (MAP) oraz modyfikacje potranslacyjne tubuliny (takie jak acetylacja czy detyryzacja) mogą altersować powinowactwo wiązania i ruchliwość kinesyn, efektywnie kierując lub ograniczając ich ruch wzdłuż specyficznych podzbiorów mikrotubul.
Regulacja białek motorowych kinesyn jest przedmiotem ciągłych badań, z implikacjami dla zrozumienia chorób neurodegeneracyjnych, nowotworów i zaburzeń rozwojowych. Wiodące organizacje, takie jak National Institutes of Health oraz Nature Publishing Group, wspierają i rozpowszechniają badań w tej dziedzinie, podkreślając znaczenie regulacji kinesyn w zdrowiu i chorobie.
Kinesyna w funkcjonowaniu neuronów i transporcie aksonalnym
Białka motorowe kinesyny to superrodzina zależnych od ATP molekularnych silników, które odgrywają kluczową rolę w transporcie wewnątrzkomórkowym, szczególnie w silnie spolaryzowanym środowisku neuronów. Te białka poruszają się wzdłuż szlaków mikrotubul, konwertując energię chemiczną z hydrolizy ATP na pracę mechaniczną, co umożliwia kierunkowy ruch różnych ładunków komórkowych. W neuronach, kinesyny są niezbędne do transportu organelli, prekursorów pęcherzyków synaptycznych, białek i mRNA z ciała komórkowego (soma) do końca aksonu, procesu nazywanego transportem aksonalnym anterogradowym.
Superrodzina kinesyn jest zróżnicowana, z ponad 40 różnymi genami kinesyn zidentyfikowanymi u ludzi, z których każdy koduje białka o specjalizowanych funkcjach i specyficzności ładunków. Najlepiej scharakteryzowany członek, kinesyna-1 (znana również jako konwencjonalna kinesyna), jest heterotetramerym składającym się z dwóch łańcuchów ciężkich i dwóch łańcuchów lekkich. Łańcuchy ciężkie zawierają domeny motorowe odpowiedzialne za hydrolizę ATP i wiązanie mikrotubuli, podczas gdy lekkie łańcuchy pośredniczą w rozpoznawaniu i wiązaniu ładunków. Ta organizacja strukturalna pozwala kinesynie-1 na transportowanie różnorodnych ładunków krytycznych dla funkcjonowania neuronów i ich przetrwania.
Transport aksonalny jest niezbędny dla utrzymania zdrowia i funkcji neuronów, biorąc pod uwagę ekstremalną długość niektórych aksonów, które mogą sięgać nawet metra u ludzi. Transport anterogradowy napędzany przez kinesyny zapewnia terminowe dostarczanie komponentów synaptycznych, mitochondriów i innych niezbędnych organelli do odległych obszarów neuronu. Zakłócenie funkcji kinesyn może prowadzić do deficytów w transmisji synaptycznej, degeneracji aksonu i zostało powiązane z wieloma chorobami neurodegeneracyjnymi, w tym chorobą Alzheimera oraz stwardnieniem zanikowym bocznym (ALS). Znaczenie transportu mediowanego przez kinesyny w zdrowiu neuronów podkreślają badania wiodących organizacji naukowych, takich jak National Institutes of Health oraz National Institute of Neurological Disorders and Stroke, które podkreślają związek między defektami transportu aksonalnego a neurodegeneracją.
Oprócz transportu anterogradowego, kinesyny koordynują również z białkami motorowymi dyneiny, które mediują transport retrogradowy (z końca aksonu z powrotem do somy), aby utrzymać dwukierunkowy przepływ materiałów niezbędny dla homeostazy neuronów. Precyzyjna regulacja aktywności kinesyn, wyboru ładunków i koordynacji z innymi białkami motorowymi jest przedmiotem ongoing badań, z implikacjami dla zrozumienia molekularnych podstaw łączności neuronów, plastyczności i chorób.
Analiza porównawcza: Kinesyna vs. Dyneina i Miozyna
Białka motorowe kinesyny to fundamentalna klasa molekularnych silników, które odgrywają kluczową rolę w transporcie wewnątrzkomórkowym, szczególnie wzdłuż mikrotubul. Aby w pełni docenić ich znaczenie biologiczne, należy porównać kinesyny z pozostałymi dwoma głównymi rodzinami białek motorowych cytoszkieletu: dyneinami i miozynami. Każde z tych białek motorowych jest wyspecjalizowane do ruchu wzdłuż odmiennych filamentów cytoszkieletowych i jest dostosowane do specyficznych funkcji komórkowych.
Kinesyny i dyneiny poruszają się po mikrotubulach, ale różnią się kierunkiem i specyfiką ładunków. Kinesyny zazwyczaj poruszają się w kierunku dodatniego końca mikrotubuli, co zazwyczaj jest skierowane w stronę peryferii komórkowej, ułatwiając anterogradowy transport organelli, pęcherzyków i kompleksów białkowych. W przeciwieństwie do tego, dyneiny poruszają się w kierunku ujemnego końca mikrotubuli, kierując ładunki w stronę środka komórki, takiego jak jądro czy centrum organizacji mikrotubuli. Ten dwukierunkowy system zapewnia efektywne rozmieszczenie i recykling komponentów komórkowych. Strukturalnie, kinesyny są zazwyczaj homodimerycznymi lub heterodimerycznymi białkami z dwiema domenami motorowymi, podczas gdy cytozolowe dyneiny to duże, wielo podjednostkowe kompleksy z bardziej złożonym mechanizmem generacji siły i regulacji (National Institute of Genetics).
Miozyny, z drugiej strony, to głównie białka motorowe oparte na aktynie. Najlepiej znane są z roli w skurczu mięśni, ale uczestniczą także w różnych procesach komórkowych, takich jak cytokineza, transport pęcherzyków i ruchliwość komórkowa. W przeciwieństwie do kinesyn i dynein, które poruszają się po mikrotubulach, miozyny poruszają się wzdłuż filamentów aktynowych, zwykle w kierunku dodatniego (barwnego) końca. Organizacja strukturalna miozyn jest odmienna, z charakterystyczną domeną głowy, która wiąże aktynę i hydrolizuje ATP, regionem szyi oraz ogonem, który determinuje specyfikę ładunków (National Institutes of Health).
Funkcjonalnie, trzy rodziny białek motorowych są dostosowane do swoich odpowiednich szlaków cytoszkieletowych i ról komórkowych. Kinesyny są kluczowe dla długozasięgowego, kierunkowego transportu w neuronach oraz komórkach dzielących się, podczas gdy dyneiny są niezbędne dla transportu retrogradowego i ruchu rzęskowego/flagesralnego. Miozyny, w przeciwieństwie do tego, są kluczowe w procesach wymagających generacji siły i transportu krótkozasięgowego w sieciach aktynowych. Współdziałanie tych motorów zapewnia dynamiczną organizację i zdolność adaptacyjną komórki eukariotycznej.
Podsumowując, podczas gdy kinesyny, dyneiny i miozyny dzielą fundamentalną właściwość konwertowania energii chemicznej z hydrolizy ATP na pracę mechaniczną, są wyspecjalizowane do różnych szlaków, kierunków i funkcji komórkowych. Ich skoordynowane działanie jest niezbędne do utrzymania architektury komórkowej, sygnalizacji i homeostazy.
Choroby związane z kinesynami i cele terapeutyczne
Białka motorowe kinesyny to niezbędne molekularne maszyny, które transportują różne ładunki komórkowe wzdłuż mikrotubuli, odgrywając kluczową rolę w transporcie wewnątrzkomórkowym, mitozie oraz funkcjonowaniu neuronów. Dysregulacja lub mutacja genów kinesyn została powiązana z szeregiem ludzkich chorób, co czyni te białka istotnymi zarówno jako biomarkery, jak i potencjalne cele terapeutyczne.
Jednym z najlepiej udokumentowanych powiązań chorobowych jest członek rodziny kinesyn KIF1A. Mutacje w genie KIF1A są związane z szeregiem zaburzeń neurodegeneracyjnych, nazywanych zbiorowo zaburzeniami neurologicznymi związanych z KIF1A (KAND). Te schorzenia objawiają się jako niepełnosprawność intelektualna, spastyczna paraplegia i postępująca neurodegeneracja. Podstawowa patologia często jest przypisywana zaburzeniom transportu aksonalnego, co zakłóca funkcję synaptyczną i przetrwanie neuronów. Podobnie, mutacje w innych genach kinesyn, takich jak KIF5A i KIF21A, wiążą się z dziedziczną spastyczną paraplegią i wrodzoną fibrozą mięśni zewnętrznych oka, odpowiednio, co dodatkowo podkreśla kluczową rolę kinesyn w zdrowiu układu nerwowego.
Poza neurodegeneracją, białka motorowe kinesyny są również związane z rakiem. Na przykład KIF11 (znany również jako Eg5) jest niezbędny do formowania wrzeciona mitotycznego podczas podziału komórkowego. Nadmierna ekspresja lub hiperaktywność KIF11 została zaobserwowana w różnych nowotworach, w tym w raku piersi i prostaty, gdzie przyczynia się do niekontrolowanej proliferacji komórek. W związku z tym, KIF11 stał się obiecującym celem dla terapii przeciwnowotworowych. Kilka inhibitorów małocząsteczkowych KIF11, takich jak ispinesib, weszło do badań klinicznych, mających na celu selektywne zakłócenie podziału komórek nowotworowych przy minimalnym wpływie na normalne komórki. Opracowanie i ocena tych inhibitorów są ściśle monitorowane przez organizacje regulacyjne i badawcze, takie jak National Cancer Institute oraz U.S. Food and Drug Administration.
Strategie terapeutyczne skierowane na białka motorowe kinesyn wykraczają poza onkologię. W zaburzeniach neurodegeneracyjnych trwają starania mające na celu opracowanie cząsteczek, które mogą przywrócić lub zmodulować funkcję kinesyn, potencjalnie łagodząc deficyty transportu aksonalnego. Dodatkowo, badania wspierane przez organizacje takie jak National Institutes of Health badają terapie genowe i podejścia z użyciem małych cząsteczek w celu skorygowania lub zrelaksowania defektów aktywności kinesyn w zaburzeniach genetycznych.
Podsumowując, białka motorowe kinesyny są centralne dla zdrowia komórkowego, a ich dysfunkcja jest związana z różnymi chorobami, szczególnie w układzie nerwowym i nowotworach. Trwające badania i wysiłki rozwojowe na rzecz klinicznych wykorzystania kinesyn jako biomarkerów i celów terapeutycznych mają potencjał do przynieść nowe terapie dla aktualnie nieuleczalnych schorzeń.
Nowe badania i przyszłe kierunki
Nowe badania nad białkami motorowymi kinesynami szybko rozwijają nasze zrozumienie ich ról w procesach komórkowych oraz ich potencjalnych zastosowań w biotechnologii i medycynie. Kinesyny to superrodzina zależnych od ATP molekularnych silników, które transportują ładunki wzdłuż mikrotubuli, odgrywając istotne role w transporcie wewnątrzkomórkowym, mitoza oraz funkcjonowaniu neuronów. Ostatnie postępy w technikach obrazowania o wysokiej rozdzielczości oraz biofistyce pojedynczych cząsteczek umożliwiły badaczom wizualizowanie dynamiki kinesyn w bezprecedensowych szczegółach, ujawniając nowe spostrzeżenia na temat ich cykli mechanochemicznych i mechanizmów regulacyjnych.
Jednym z obiecujących kierunków jest wyjaśnienie różnorodności strukturalnej kinesyn oraz jej implikacji dla specyfiki ładunku i regulacji. Techniki biologii strukturalnej, takie jak kriokomikroskopia elektronowa, ujawniają odrębne stany konformacyjne członków rodziny kinesyn, sugerując specjalizowane adaptacje do różnych zadań komórkowych. Ta wiedza strukturalna informuje projektowanie małych cząsteczek i peptydów, które mogą modyfikować aktywność kinesyn, z potencjalnymi zastosowaniami terapeutycznymi w chorobach neurodegeneracyjnych i nowotworach, gdzie aberrantna funkcja kinesyn jest powiązana z patogenezą.
Synteza biologii również wykorzystuje silniki kinesyn do projektowania nanoskalowych systemów transportowych. Wykorzystując kierunkowy ruch kinesyn, badacze opracowują biomimetyczne urządzenia do celowanego dostarczania leków i budowy cząsteczek. Te innowacje mogłyby zrewolucjonizować medycynę precyzyjną poprzez umożliwienie kontrolowanego transportu środków terapeutycznych wewnątrz komórek lub tkanek.
Innym nowym obszarem jest badanie roli kinesyn w zdrowiu neuronów i chorobach. Mutacje w genach kinesyn zostały powiązane z dziedziczną spastyczną paraplegią, chorobą Charcota-Marie-Tootha oraz innymi zaburzeniami neurodegeneracyjnymi. Trwające badania mają na celu wyjaśnienie, jak te mutacje zakłócają transport aksonalny i identyfikację strategii przywracania normalnej funkcji. National Institutes of Health oraz National Institute of Neurological Disorders and Stroke wspierają inicjatywy mające na celu zbadanie molekularnych podstaw tych chorób i opracowanie strategii terapeutycznych.
Patrząc w przyszłość, integracja modelowania obliczeniowego, zaawansowanej mikroskopii i technologii edycji genomu ma przyspieszyć odkrycia w biologii kinesyn. Współpraca instytucji akademickich, agencji rządowych i firm biotechnologicznych sprzyja przekładaniu podstawowych badań na zastosowania kliniczne i przemysłowe. W miarę pogłębiania się naszego zrozumienia białek motorowych kinesyn, pojawią się nowe możliwości manipulowania transportem wewnątrzkomórkowym, diagnozowania chorób oraz projektowania innowacyjnych strategii terapeutycznych.
Źródła i odniesienia
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute