Proteinele motor Kinesin: Motoarele dinamice care stimulează logistica intracelulară. Descoperiți cum aceste mașini moleculare revoluționează funcția celulară și sănătatea.
- Introducere în proteinele motor Kinesin
- Structura moleculară și mecanismul de acțiune
- Hidroliza ATP și conversia energiei
- Recunoașterea și specificitatea legării încărcăturilor
- Cărțile de transport intracelular
- Reglarea activității Kinesin
- Kinesin în funcția neuronală și transportul axonal
- Analiză comparativă: Kinesin vs. Dynein și Myosin
- Boli legate de Kinesin și ținte terapeutice
- Cercetări emergente și direcții viitoare
- Sursa & Referințe
Introducere în proteinele motor Kinesin
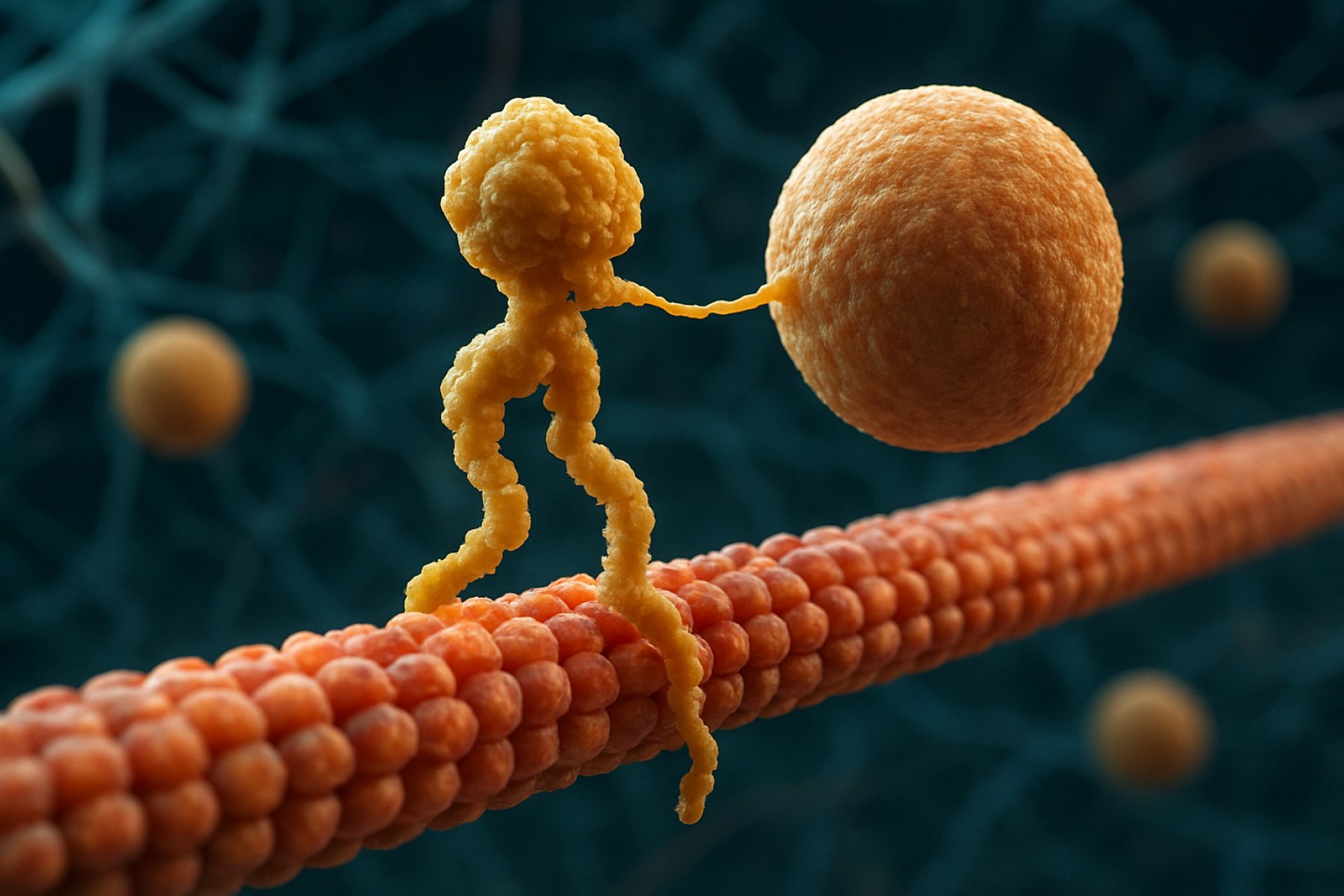
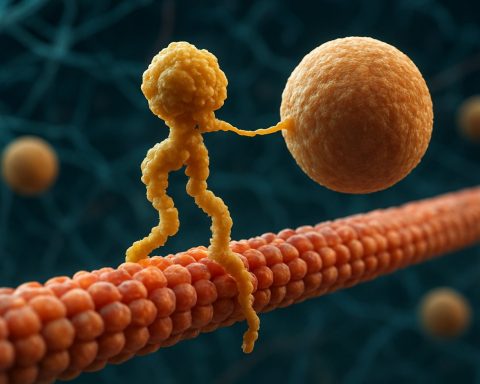
Proteinele motor Kinesin sunt o clasă fundamentală de motoare moleculare care joacă un rol critic în transportul intracelular și organizarea celulară. Descoperite în mijlocul anilor 1980, kinesinele sunt proteine dependente de ATP care se deplasează pe calea microtubulelor în cadrul celulelor eucariote, transportând o varietate de încărcături, cum ar fi organelle, vezicule, proteine și mRNA. Acest transport este esențial pentru numeroase procese celulare, inclusiv mitoză, meioză și funcția neuronală. Superfamilia kinesin este mare și diversă, cu peste 40 de gene kinesine diferite identificate la oameni, fiecare codificând proteine cu funcții specializate și specificitate pentru încărcături.
Din punct de vedere structurale, kinesinele sunt compuse de obicei din două lanțuri grele și două lanțuri ușoare. Lanțurile grele conțin un domeniu motor conservat, care se leagă de microtubule și hidrolizează ATP-ul pentru a genera mișcare. Domeniile de coadă ale kinesinelor sunt responsabile de legarea încărcăturilor, permițând motorului să transporte componente celulare specifice către destinațiile lor dorite. Mișcarea kinesinului este în general direcționată către capătul plus al microtubulelor, care de obicei corespunde periferiei celulare, deși unii membri ai familiei kinesin se deplasează spre capătul minus.
Mecanismul mișcării kinesinului este adesea descris ca o mișcare de „mână peste mână”, unde cele două domenii motor ale alternat se leagă și se eliberează de microtubul, alimentate de ciclurile de legare și hidroliză ATP. Această mișcare procesivă permite kinesinelor să călătorească pe distanțe lungi de-a lungul microtubulelor fără a se detașa, făcându-le transporte eficiente în mediul celular aglomerat. Reglarea precisă a activității kinesinului este crucială pentru menținerea homeostazei și funcției celulare.
Proteinele motor Kinesin nu sunt doar vitale pentru operațiunile celulare normale, ci sunt implicate și în diverse boli. Defectele în funcția kinesinului au fost legate de tulburări neurodegenerative, cum ar fi boala Alzheimer și paraplegia spastică ereditară, precum și anumite tipuri de cancer. Prin urmare, kinesinele sunt subiectul unor cercetări intense, atât pentru a înțelege biologia lor de bază, cât și pentru a explora potențialul lor ca ținte terapeutice.
Cercetările privind proteinele motor Kinesin sunt susținute și avansate de organizații științifice de frunte și institute de cercetare din întreaga lume, inclusiv de Institutul Național de Sănătate și de Grupul Publicației Nature, care publică în mod regulat studii revizuite de colegi privind structura, funcția și semnificația biomedicală a acestor proteine. Studiul continuu al kinesinelor continuă să dezvăluie noi perspective asupra mecanismului molecular al vieții și oferă căi promițătoare pentru dezvoltarea de intervenții medicale inovatoare.
Structura moleculară și mecanismul de acțiune
Proteinele motor Kinesin sunt o superfamilie de motoare moleculare dependente de ATP care joacă un rol crucial în transportul intracelular, în special de-a lungul căilor microtubulare. Din punct de vedere structural, kinesinele sunt de obicei compuse din două lanțuri grele și două lanțuri ușoare, formând un complex heterotetrameric. Lanțurile grele conțin un domeniu motor N-terminal foarte conservat (cunscut și sub numele de „cap”), un stâlp învârtit și un domeniu de coadă C-terminal. Domeniul motor este responsabil pentru legarea de microtubule și hidroliză ATP, care oferă energia necesară pentru mișcare. În contrast, domeniul de coadă este implicat în recunoașterea și legarea încărcăturilor, interacționând adesea cu proteine adaptor sau direct cu veziculele și organellele.
Mecanismul de acțiune al proteinelor motor Kinesin este adesea descris ca o mișcare de „mână peste mână”. Fiecare moleculă de kinesin are două domenii motor care se leagă alternativ și se eliberează de microtubul, coordonat de legarea și hidroliza ATP. Atunci când un cap se leagă de microtubul și hidrolizează ATP, acesta suferă o schimbare conformațională care propulsează celălalt cap înainte către următorul sit de legare, situat la aproximativ 8 nanometri distanță. Acest proces se repetă, permițând kinesinelor să „meargă” unidirecțional de-a lungul microtubulelor, în general către capătul plus, care este orientat spre periferia celulară. Acțiunea coordonată a celor două capete asigură procesivitate, ceea ce înseamnă că kinesinul poate face multe pași de-a lungul unui microtub fără a se disocia, lucru esențial pentru transportul eficient al încărcăturilor pe distanțe lungi în cadrul celulei.
Kinesinele sunt extrem de diverse, cu peste 40 de gene kinesin diferite identificate la oameni, fiecare adaptată pentru funcții celulare specifice. Deși cele mai multe kinesine se mișcă spre capătul plus al microtubulelor, unele, cum ar fi membrii familiei kinesin-14, se îndreaptă spre capătul minus, evidențiind versatilitatea funcțională a acestei familii de proteine. Activitatea și direcția kinesinelor sunt determinate de diferențe subtile în domeniile lor motor și regiunile de reglare asociate.
Studiul structurii și funcției kinesinelor a fost avansat de tehnici de înaltă rezoluție, cum ar fi cristalografia cu raze X și microscopia electronică crio, care au dezvăluit perspective detaliate asupra schimbărilor conformaționale care stau la baza motilității lor. Aceste descoperiri au fost instrumentale în înțelegerea nu doar a biologiei celulare fundamentale, ci și a bazei moleculare a bolilor legate de disfuncția kinesinului, cum ar fi anumite tulburări neurodegenerative și cancere. Organizații de cercetare de frunte, inclusiv Institutul Național de Sănătate și Laboratorul European de Biologie Moleculară, continuă să investigheze mecanismele moleculare ale proteinelor motor Kinesin, subliniind importanța lor fundamentală în biologia celulară.
Hidroliza ATP și conversia energiei
Proteinele motor Kinesin sunt mașini moleculare esențiale care convertesc energia chimică în muncă mecanică, permițând transportul diverselor încărcături celulare de-a lungul microtubulelor. Procesul fundamental care stă la baza acestei mișcări este hidroliza trifosfatului de adenosină (ATP), care furnizează energia necesară pentru schimbările conformaționale ale kinesinului și motilitatea direcțională.
Hidroliza ATP are loc la domeniile motor (cunoscuți și sub numele de „capete”) ale dimerului kinesin. Fiecare cap conține un situs de legare a nucleotidelor foarte conservat care leagă alternativ și hidrolizează ATP. Ciclu mecanochemic începe atunci când un cap de kinesin, strâns legat de microtubul, se leagă de ATP. Această legare induce o schimbare conformațională în regiunea legăturii gâtului, propulsând capul din spate înainte într-o mișcare de „mână peste mână”. În timp ce capul din frunte se leagă de următoarea subunitate de tubulină, ATP-ul este hidrolizat în difosfat de adenosină (ADP) și fosfat anorganic (Pi), eliberând energie care este transformată în mișcare mecanică. Eliberarea Pi și schimbul ulterioare al ADP-ului pentru ATP resetează ciclul, permițând o mișcare procesivă continuă de-a lungul microtubului.
Eficiența conversiei energiei în kinesin este remarcabilă. Fiecare moleculă de ATP hidrolizată rezultă într-un pas de 8 nanometri de-a lungul microtubului, cu pierderi de energie minime. Această eficiență înaltă se datorează legăturii strânse între hidroliza ATP-ului și mecanismul de pășire mecanică. Procesul este foarte reglat, asigurând că hidroliza ATP-ului are loc doar atunci când capul kinesinului este angajat corect cu microtubul, prevenind astfel cheltuirea inutilă a energiei.
Activitatea ATPazei în kinesin este, de asemenea, modulată de prezența încărcăturii și de tipul specific de membru al familiei kinesin implicat. De exemplu, kinesinul convențional-1 este foarte procesiv, capabil să facă sute de pași fără a se disocia de microtub, în timp ce alți membri ai familiei kinesin pot avea rate diferite de hidroliză a ATP-ului și comportamente de pășire, adaptate funcțiilor lor celulare.
Studiul hidrolizei ATP și conversiei energiei în kinesin a fost esențial pentru înțelegerea mecanismelor de transport intracelular și a principiilor mai largi ale funcției motoarelor moleculare. Cercetările în acest domeniu sunt susținute de organizații științifice de frunte, cum ar fi Institutul Național de Sănătate și Fundația Națională pentru Știință, care finanțează investigațiile asupra biologiei structurale și biofizicii proteinelor motor. Perspectivele câștigate din aceste studii au implicații pentru neurobiologie, diviziunea celulară și dezvoltarea de aplicații nanotehnologice care imită motoarele biologice.
Recunoașterea și specificitatea legării încărcăturilor
Proteinele motor Kinesin sunt mașini moleculare esențiale care transportă o mare varietate de încărcături intracelulare de-a lungul căilor microtubulare, jucând un rol pivot în procese precum poziționarea organellelor, traficarea veziculelor și mitoză. Specificitatea cu care kinesinele recunosc și se leagă de încărcăturile lor este fundamentală pentru fidelitatea și reglementarea transportului intracelular. Această specificitate este obținută printr-o combinație de caracteristici structurale, proteine adaptor și mecanisme de reglare.
Superfamilia kinesin se caracterizează printr-un domeniu motor conservat responsabil pentru hidroliza ATP și legarea de microtubule, dar funcțiile de recunoaștere și legare a încărcăturilor sunt mediate în principal de domeniile variabile ale cozii. Aceste regiuni de coadă diferă semnificativ între membrii familiei kinesin, permițând interacțiuni selective cu încărcături distincte. De exemplu, kinesin-1 (cunoscut și sub numele de kinesin convențional) își utilizează coada C-terminală pentru a se lega de o varietate de încărcături, inclusiv organelle legate de membrană și vezicule, adesea prin intermediul proteinelor adaptor, cum ar fi lanțurile ușoare kinesin (KLC). KLC-urile conțin motive de tip tetratricopeptid (TPR) care facilitează recunoașterea proteinelor asociate cu încărcătura specifică, conferind astfel selectivitate procesului de transport.
Proteinele adaptor joacă un rol crucial în conectarea kinesinelor la încărcăturile lor. Aceste adaptoare pot recunoaște semnale sau motive specifice de pe suprafața încărcăturii, asigurând că doar încărcătura corespunzătoare este transportată de o anumită kinesin. De exemplu, interacțiunea dintre KLC și membrii familiei JIP (proteine care interacționează cu kinaza c-Jun N-terminal) este bine documentată în transportul neuronal, unde JIP-urile acționează ca schele legând kinesin-1 de vezicule care conțin molecule de semnalizare. Alți membri ai familiei kinesin, cum ar fi kinesin-3, utilizează diferite adaptoare și structuri ale domeniului de coadă pentru a obține specificitatea pentru încărcături, reflectând diversitatea încărcăturilor și a contextelor celulare în care acționează kinesinele.
Reglarea legării încărcăturii este, de asemenea, realizată prin modificări post-translaționale și interacțiuni competitive. Fosforilarea cozii kinesin sau a proteinelor adaptor poate modifica afinitatea de legare, permițând un control dinamic asupra atașării și eliberării încărcăturii în răspuns la semnalele celulare. În plus, unele încărcături pot concura pentru legarea la aceeași kinesin, introducând o altă etapă de reglementare care asigură o distribuție corectă a încărcăturilor.
Studiul recunoașterii încărcăturilor și specificității legării în proteinele motor Kinesin este un domeniu în rapidă evoluție, având implicații pentru înțelegerea bolilor neurodegenerative, tulburărilor de trafic intracelular și dezvoltarea terapeuticelor țintite. Organizații de cercetare de frunte, precum Institutul Național de Sănătate și Organizația Europeană de Biologie Moleculară susțin investigațiile în curs asupra mecanismelor moleculare care stau la baza interacțiunilor kinesin-încărcătură, subliniind semnificația biomedicală a acestui domeniu.
Cărțile de transport intracelular
Proteinele motor Kinesin sunt mașini moleculare esențiale care conduc transportul intracelular de-a lungul căilor microtubulare, asigurând livrarea precisă a organellelor, veziculelor, proteinelor și altor încărcături în cadrul celulelor eucariote. Aceste motoare dependente de ATP se caracterizează prin abilitatea lor de a transforma energia chimică în muncă mecanică, facilitând mișcarea componentelor celulare pe distanțe lungi cu o direcție și specificitate remarcabile.
Din punct de vedere structural, kinesinele constau de obicei din două lanțuri grele formând un dimer, fiecare având un domeniu motor globular (cap) care se leagă de microtubule și hidrolizează ATP. Domeniile de coadă sunt responsabile pentru recunoașterea și legarea încărcăturilor, adesea în asociere cu lanțuri ușoare sau proteine adaptor. Cel mai bine studiat membru, kinesin-1, se mișcă predominant spre capătul plus al microtubulelor, care corespunde de obicei periferiei celulare, jucând astfel un rol pivot în transportul anterograd.
Mecanismul mișcării kinesinului este adesea descris ca o mișcare de „mână peste mână”, unde cele două domenii motor se leagă alternativ și pășesc de-a lungul rețelei microtubulare. Fiecare pas este strâns legat de hidroliza unei singure molecule de ATP, asigurând procesivitate și direcționalitate. Această mișcare coordonată permite kinesinelor să transporte încărcături pe distanțe care pot acoperi întreaga lungime a unui neuron sau a altor tipuri de celule mari.
Kinesinele sunt clasificate în mai multe familii pe baza omologiei secvenței și specializării funcționale. Deși kinesin-1 este implicat în principal în transportul organellelor și veziculelor, alte familii precum kinesin-2 și kinesin-3 au roluri distincte în transportul ciliat și traficarea veziculelor sinaptice, respectiv. Unele kinesine, cum ar fi kinesin-5, sunt implicate în dinamica fusului mitotic în loc de transportul încărcăturilor, evidențiind diversitatea funcțională din cadrul acestei superfamilii de proteine.
Activitatea motoarelor kinesin este strâns reglată de căile de semnalizare celulară, modificări post-translaționale și interacțiuni cu proteinele asociate microtubulelor. Această reglementare asigură că încărcăturile sunt livrate în locațiile subcelulare corecte în răspuns la nevoile fiziologice. Perturbarea transportului mediat de kinesin a fost implicată în diverse boli, inclusiv tulburări neurodegenerative, unde transportul axonal defectuos contribuie la disfuncția și degenerarea neuronală.
Cercetările asupra proteinelor motor Kinesin continuă să avanseze înțelegerea noastră a logisticii celulare și au inspirat dezvoltarea de nanodispozitive biomimetice. Organizații științifice de frunte, precum Institutul Național de Sănătate și Grupul Publicației Nature publică regulat studii fundamentale și recenzii asupra structurii, funcției și semnificației biomedicale a motoarelor kinesin, subliniind rolul lor central în biologia celulară.
Reglarea activității Kinesin
Proteinele motor Kinesin sunt mașini moleculare esențiale care transportă încărcături de-a lungul microtubulelor în cadrul celulelor eucariote. Reglarea activității kinesin este crucială pentru menținerea organizării celulare, asigurând distribuția corespunzătoare a organellelor și sprijinind procese precum mitoză și funcția neuronală. Există mai multe straturi de reglementare pentru a controla când, unde și cum interacționează kinesinele cu încărcăturile lor și cu căile microtubulare.
Un mecanism primar de reglementare este prin autoinhibare. Multe membre ale familiei kinesin, cum ar fi kinesin-1, au domenii de coadă care se pot plia și interacționa cu domeniile lor motor, împiedicând activitatea ATPazei și legarea de microtubule în absența încărcăturii. Această conformație autoinhibată este eliberată odată cu legarea încărcăturii, ceea ce induce o schimbare conformațională care activează motorul pentru o mișcare procesivă. Acest mecanism asigură că kinesinele sunt active doar atunci când este necesar, prevenind consumul inutil de ATP și potențialele daune celulare.
Modificările post-translaționale (PTMs) joacă, de asemenea, un rol semnificativ în modularea activității kinesin. Fosforilarea este cea mai studiată PTM, cu kinaze precum kinazele dependente de ciclini (CDKs) și kinaza de sinteză a glicogenului 3 (GSK3) fosforilând reziduuri specifice pe proteinele kinesin. Aceste modificări pot îmbunătăți sau inhiba activitatea motorului, în funcție de context și de kinesinul specific implicat. De exemplu, fosforilarea kinesin-1 de către GSK3 inhibă capacitatea sa de a se lega de microtubule, regland astfel transportul axonal în neuroni.
Proteinele adaptor de încărcătură rafinează și mai mult reglementarea kinesinului. Aceste adaptoare, cum ar fi JIP1 și Milton, leagă kinesinele de încărcături specifice și pot modula activitatea motorului prin stabilizarea conformației active sau prin recrutarea unor factori de reglementare suplimentari. Interacțiunea dintre adaptoare și motoare permite un control precis asupra livrării încărcăturilor, ceea ce este deosebit de critic în celulele foarte polarizate, cum ar fi neuronii.
În plus, căile microtubulare în sine pot influența activitatea kinesinului. Proteinele asociate microtubulelor (MAPs) și modificările post-translaționale ale tubulinei (cum ar fi acetilarea sau detyrosinarea) pot modifica afinitatea de legare și motilitatea kinesinelor, călăuzindu-le sau restricționându-le mișcarea de-a lungul unor subseturi specifice de microtubule.
Reglarea proteinelor motor Kinesin este un subiect de cercetare în curs, având implicații pentru înțelegerea bolilor neurodegenerative, cancerului și a tulburărilor de dezvoltare. Organizații de frunte, cum ar fi Institutul Național de Sănătate și Grupul Publicației Nature sprijină și diseminează cercetări în acest domeniu, subliniind importanța reglementării kinesinului în sănătate și boală.
Kinesin în funcția neuronală și transportul axonal
Proteinele motor Kinesin sunt o superfamilie de motoare moleculare dependente de ATP care joacă un rol crucial în transportul intracelular, în special în mediul extrem de polarizat al neuronilor. Aceste proteine se deplasează de-a lungul căilor microtubulare, convertind energia chimică din hidroliza ATP în muncă mecanică, ceea ce permite mișcarea direcționată a diferitelor încărcături celulare. În neuroni, kinesinele sunt esențiale pentru transportul organellelor, precursorilor veziculelor sinaptice, proteinelor și mRNA-urilor de la corpul celular (soma) la terminația axonală, un proces cunoscut sub numele de transport axonal anterograd.
Superfamilia kinesin este diversă, cu peste 40 de gene kinesin diferite identificate la oameni, fiecare codificând proteine cu funcții specializate și specificități pentru încărcături. Cel mai bine caracterizat membru, kinesin-1 (cunoscut și sub numele de kinesin convențional), este un heterotetramer compus din două lanțuri grele și două lanțuri ușoare. Lanțurile grele conțin domeniile motor responsabile pentru hidroliza ATP și legarea de microtubule, în timp ce lanțurile ușoare medierează recunoașterea și legarea încărcăturilor. Această organizare structurală permite kinesin-ului-1 să transporte o mare varietate de încărcături critice pentru funcția neuronală și supraviețuire.
Transportul axonal este vital pentru menținerea sănătății și funcției neuronale, având în vedere lungimea extremă a unora dintre axoni, care pot extinde până la un metru în oameni. Transportul anterograd condus de kinesin asigură livrarea în timp util a componentelor sinaptice, mitocondriilor și altor organelle esențiale către regiunile distale ale neuronului. Perturbarea funcției kinesinului poate duce la deficite în transmiterea sinaptică, degenerarea axonală și a fost implicată în mai multe boli neurodegenerative, cum ar fi boala Alzheimer și scleroza laterală amiotropică (ALS). Importanța transportului mediat de kinesin în sănătatea neuronală este subliniată de cercetările efectuate de organizații științifice de frunte, cum ar fi Institutul Național de Sănătate și Institutul Național de Tulburări Neurologice și Accident Vasculare Cerebrale, care au evidențiat legătura dintre defectele transportului axonal și neurodegenerare.
În plus față de transportul anterograd, kinesinele coordonează și cu proteinele motor dynein, care mediatează transportul retrograd (de la terminația axonală înapoi la soma), pentru a menține fluxul bidirecțional al materialelor necesar pentru homeostaza neuronală. Reglarea precisă a activității kinesinului, selecția încărcăturii și coordonarea cu alte proteine motor este un subiect de cercetare în curs, având implicații pentru înțelegerea bazei moleculare a conectivității neuronale, plasticității și bolii.
Analiză comparativă: Kinesin vs. Dynein și Myosin
Proteinele motor Kinesin sunt o clasă fundamentală de motoare moleculare care joacă un rol critic în transportul intracelular, în special de-a lungul căilor microtubulare. Pentru a aprecia pe deplin semnificația lor biologică, este esențial să comparăm kinesinele cu celelalte două mari familii de proteine motor de citoschelet: dyneinele și miozinele. Fiecare dintre aceste proteine motor este specializată pentru mișcarea pe filamentele citoscheletice distincte și este adaptată pentru funcții celulare specifice.
Kinesinele și dyneinele traversează ambele microtubule, dar se diferențiază prin direcția lor și specificitatea încărcăturii. Kinesinele se mișcă de obicei spre capătul plus al microtubulelor, care este de obicei orientat spre periferia celulară, facilitând transportul anterograd al organellelor, veziculelor și complecșelor proteice. În contrast, dyneinele se mișcă spre capătul minus al microtubulelor, îndreptând încărcăturile spre centrul celulei, cum ar fi nucleul sau centrul organizator microtubular. Acest sistem bidirecțional asigură distribuția și reciclarea eficientă a componentelor celulare. Din punct de vedere structural, kinesinele sunt de obicei proteine homodimerice sau heterodimerice cu două domenii motor, în timp ce dyneinele citoplasmatice sunt complexe mari, cu multiple subunități, având un mecanism mai complex de generare și reglementare a forței (Institutul Național de Genetica).
Miozinele, pe de altă parte, sunt în principal proteine motor bazate pe actină. Ele sunt celebre pentru rolul lor în contracția musculară, dar participă și la o varietate de procese celulare non-musculare, cum ar fi citokineza, transportul veziculelor și motilitatea celulară. Spre deosebire de kinesine și dyneine, care se mișcă de-a lungul microtubulelor, miozinele traversează filamentele de actină, de obicei spre capătul plus (barbed). Organizarea structurală a miozinelor este distinctă, având un domeniu caracteristic de cap care se leagă de actină și hidrolizează ATP, o regiune de gât și o coadă care determină specificitatea încărcăturii (Institutul Național de Sănătate).
Funcțional, cele trei familii de proteine motor sunt adaptate la căile lor respective de citoschelet și rolurile celulare. Kinesinele sunt esențiale pentru transportul pe distanțe lungi, direcțional în neuroni și celule în diviziune, în timp ce dyneinele sunt esențiale pentru transportul retrograd și mișcarea ciliară/flagelată. Miozinele, în contrast, sunt centrale pentru procesele care necesită generarea de forță și transportul pe distanțe scurte pe rețelele de actină. Interacțiunea dintre aceste motoare asigură organizarea dinamică și adaptabilitatea celulei eucariote.
În concluzie, deși kinesinele, dyneinele și miozinele împărtășesc proprietatea fundamentală de a converti energia chimică din hidroliza ATP în muncă mecanică, ele sunt specializate pentru diferite căi, direcții și funcții celulare. Acțiunile lor coordonate sunt vitale pentru menținerea arhitecturii celulare, semnalizării și homeostazei.
Boli legate de Kinesin și ținte terapeutice
Proteinele motor Kinesin sunt mașini moleculare esențiale care transportă diverse încărcături celulare de-a lungul microtubulelor, jucând un rol pivot în traficarea intracelulară, mitoză și funcția neuronală. Dereglementarea sau mutația genelor kinesin a fost implicată într-o gamă largă de boli umane, făcând aceste proteine semnificative atât ca biomarkeri, cât și ca potențiale ținte terapeutice.
Una dintre cele mai bine documentate asociații cu boli implică membrul familiei kinesin KIF1A. Mutațiile în gena KIF1A sunt legate de un spectru de tulburări neurodegenerative, denumite colectiv tulburare neurologică asociată KIF1A (KAND). Aceste condiții se manifestă prin pornire intelectuală, paraplegie spastică și neurodegenerare progresivă. Patologia de bază este adesea atribuită transportului axonal afectat, care perturbă funcția sinaptică și supraviețuirea neuronală. În mod similar, mutațiile în alte gene kinesin, cum ar fi KIF5A și KIF21A, sunt asociate cu paraplegia spastică ereditară și fibroză congenitală a mușchilor extraoculari, respectiv, subliniind rolul critic al kinesinelor în sănătatea sistemului nervos.
Pe lângă neurodegenerare, proteinele motor Kinesin sunt de asemenea implicate în cancer. De exemplu, KIF11 (cunoscut și sub numele de Eg5) este esențial pentru formarea fusului mitotic în timpul diviziunii celulare. Supraexprimarea sau hiperactivitatea KIF11 a fost observată în diverse tipuri de cancer, inclusiv cancerul de sân și cancerul de prostată, unde contribuie la proliferarea celulară necontrolată. Prin urmare, KIF11 a devenit o țintă promițătoare pentru terapiile anti-mitotice în cancer. Mai multe inhibitori de mici molecule ai KIF11, cum ar fi ispinesib, au intrat în studii clinice, având ca scop perturbarea selectivă a diviziunii celulare canceroase, în timp ce se protejează celulele normale. Dezvoltarea și evaluarea acestor inhibitori sunt monitorizate cu atenție de organizații de reglementare și cercetare, cum ar fi Institutul Național al Cancerului și Administrația SUA pentru Alimente și Medicamente.
Strategiile terapeutice care vizează proteinele motor Kinesin se extind dincolo de oncologie. În bolile neurodegenerative, se fac eforturi pentru a dezvolta molecule care pot restabili sau modula funcția kinesin, ameliorând potențial deficitele de transport axonal. În plus, cercetările susținute de organizații precum Institutul Național de Sănătate explorează terapia genică și abordările cu mici molecule pentru a corecta sau compensa activitatea defectuoasă a kinesinului în tulburările genetice.
În concluzie, proteinele motor Kinesin sunt centrale pentru sănătatea celulară, iar disfuncțiile lor sunt legate de o varietate de boli, în special în sistemul nervos și în cancer. Eforturile de cercetare în curs și dezvoltarea clinică continuă să exploreze kinesinele atât ca biomarkeri, cât și ca ținte terapeutice, cu potențialul de a genera tratamente inovatoare pentru condiții care sunt în prezent greu de tratat.
Cercetări emergente și direcții viitoare
Cercetările emergente asupra proteinelor motor Kinesin își extind rapid înțelegerea rolurilor lor în procesele celulare și aplicațiile lor potențiale în biotehnologie și medicină. Kinesinele sunt o superfamilie de motoare moleculare dependente de ATP care transportă încărcături de-a lungul microtubulelor, jucând roluri esențiale în traficarea intracelulară, mitoză și funcția neuronală. Progresele recente în imagistica de înaltă rezoluție și biofizica moleculelor unice au permis cercetătorilor să vizualizeze dinamica kinesinelor cu un detaliu fără precedent, dezvăluind noi perspective asupra ciclurilor lor mecanochemice și mecanismele de reglementare.
O direcție promițătoare implică elucidarea diversității structurale a kinesinelor și implicațiile acesteia pentru specificitatea și reglementarea încărcăturilor. Tehnicile de biologie structurală, cum ar fi microscopia electronică crio, au descoperit stări conformaționale distincte ale membrilor familiei kinesin, sugerând adapții specializate pentru diferite sarcini celulare. Această cunoștință structurală informează proiectarea de mici molecule și peptide care pot modula activitatea kinesin, având aplicații terapeutice potențiale în bolile neurodegenerative și cancer, unde funcția anormală a kinesinului este implicată în patogeneză.
Biologia sintetică valorifică, de asemenea, motoarele kinesin pentru a proiecta sisteme de transport la scară nanometrică. Prin valorificarea mișcării direcționale a kinesinelor, cercetătorii dezvoltă dispozitive biomimetice pentru livrarea țintită a medicamentelor și ansamblarea moleculară. Aceste inovații ar putea revoluționa medicina de precizie prin permiterea transportului controlat al agenților terapeutici în cadrul celulelor sau țesuturilor.
O altă zonă emergentă este studiul rolului kinesinelor în sănătatea neuronală și boli. Mutațiile genelor kinesin au fost legate de paraplegia spastică ereditară, boala Charcot-Marie-Tooth și alte tulburări neurodegenerative. Cercetările în curs își propun să clarifice modul în care aceste mutații perturbă transportul axonal și să identifice strategii pentru restabilirea funcției normale. Institutul Național de Sănătate și Institutul Național de Tulburări Neurologice și Accident Vasculare Cerebrale susțin inițiative de investigare a fundamentelor moleculare ale acestor boli și de a dezvolta intervenții țintite.
Privind spre viitor, integrarea modelării computaționale, a microscopiei avansate și a tehnologiilor de editare genomică se așteaptă să accelereze descoperirile în biologia kinesinelor. Eforturile colaborative între instituții de învățământ, agenții guvernamentale și companii de biotehnologie favorizează traducerea cercetării fundamentale în aplicații clinice și industriale. Pe măsură ce înțelegerea noastră asupra proteinelor motor Kinesin se adâncește, noi oportunități vor apărea pentru manipularea transportului intracelular, diagnosticul bolilor și proiectarea de strategii terapeutice inovatoare.
Sursa & Referințe
- Institutul Național de Sănătate
- Grupul Publicației Nature
- Laboratorul European de Biologie Moleculară
- Fundația Națională pentru Știință
- Organizația Europeană de Biologie Moleculară
- Institutul Național de Genetică
- Institutul Național al Cancerului