Kinesínové motorové proteíny: Dynamické motory poháňajúce intracelulárnu logistiku. Objavte, ako tieto molekulárne stroje revolučne menia funkciu buniek a zdravie.
- Úvod do kinesínových motorových proteínov
- Molekulárna štruktúra a mechanizmus pôsobenia
- Hydrolýza ATP a konverzia energie
- Rozpoznávanie nákladu a viazanie špecifickosti
- Intracelulárne transportné dráhy
- Regulácia aktivity kinesínu
- Kinesín v neurónovej funkcii a axonálnom transporte
- Porovnávacia analýza: Kinesín verzus dyneín a myozín
- Choroby spojené s kinesínmi a terapeutické ciele
- Nové výskumy a budúce smery
- Zdroje a odkazy
Úvod do kinesínových motorových proteínov
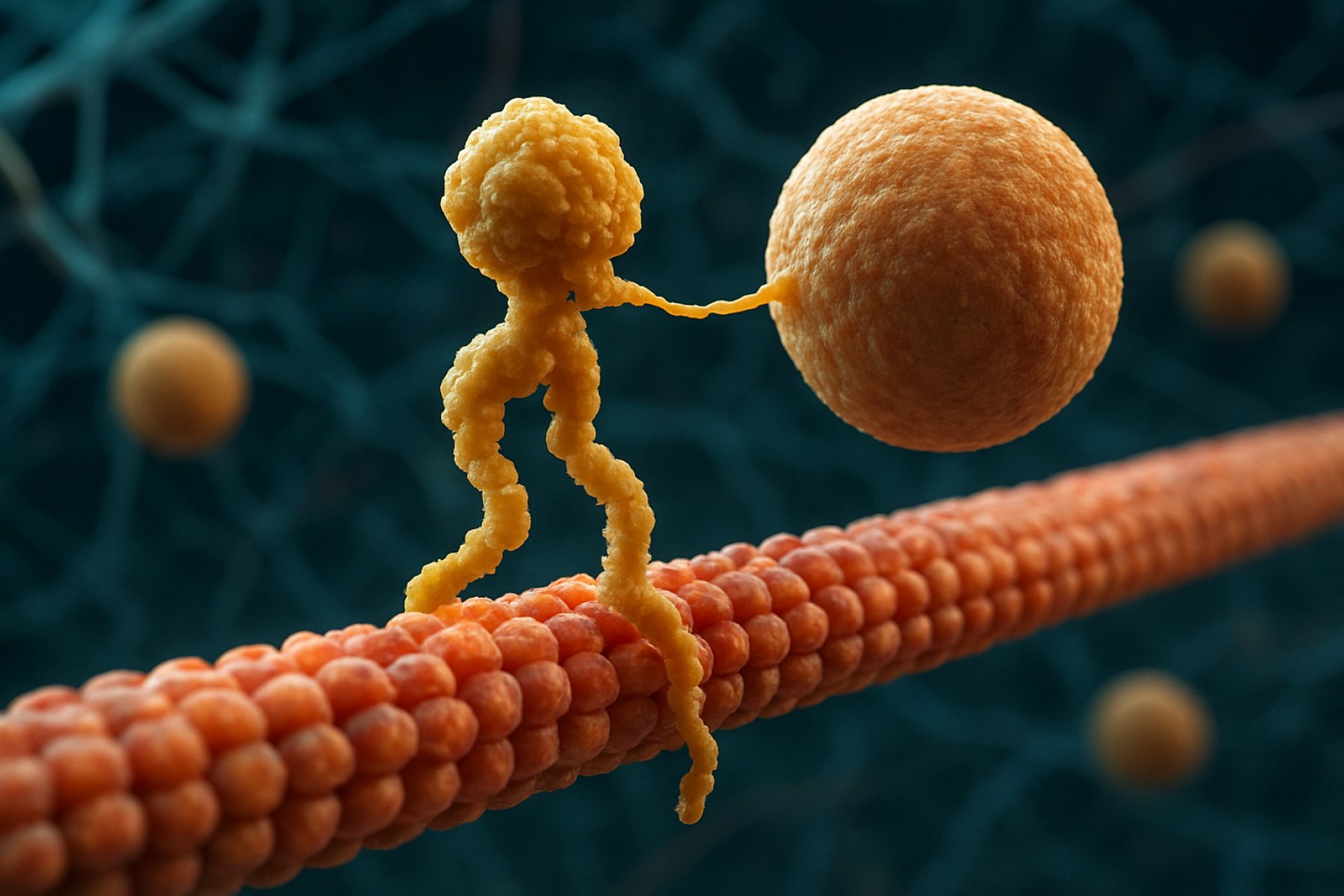
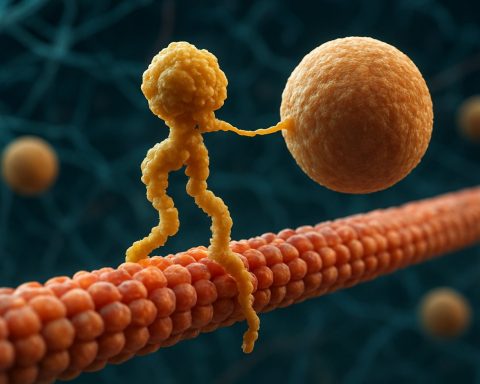
Kinesínové motorové proteíny sú základnou triedou molekulárnych motorov, ktoré hrajú kľúčovú úlohu v intracelulárnom transporte a organizácii buniek. Objavené v polovici 80. rokov 20. storočia, kinesíny sú proteíny závislé od ATP, ktoré sa pohybujú pozdĺž mikrotrubičkových dráh vo eukaryotických bunkách, transportujúc rôzne náklady ako organely, vezikuly, proteíny a mRNA. Tento transport je nevyhnutný pre množstvo bunkových procesov, vrátane mitózy, meiózy a neurónovej funkcie. Superrodina kinesínov je veľká a rozmanitá, s viac ako 40 rôznymi kinesínovými génmi identifikovanými u ľudí, pričom každý kóduje proteíny s špecializovanými funkciami a špecifickosťami pre náklad.
Štrukturálne sa kinesíny typicky skladajú z dvoch ťažkých reťazcov a dvoch ľahkých reťazcov. Ťažké reťazce obsahujú konzervovaný motorový domén, ktorý sa viaže na mikrotrubičky a hydrolýzuje ATP na generovanie pohybu. Chvostové domény kinesínov sú zodpovedné za viazanie nákladu, čo umožňuje motoru transportovať konkrétne bunkové komponenty na ich zamýšľané destinácie. Pohyb kinesínu je zvyčajne nasmerovaný k plusovému koncu mikrotrubičiek, čo zvyčajne zodpovedá periférii bunky, hoci niektoré členovia rodiny kinesínov sa pohybujú smerom k mínusovému koncu.
Mechanizmus pohybu kinesínu je často opísaný ako „ruka nad rukou“ chôdza, kde sa dva motorové domény striedavo viažu a uvoľňujú mikrotrubičku, pričom sú poháňané cyklami viazania a hydrolýzy ATP. Tento procesívny pohyb umožňuje kinesínom prekonávať dlhé vzdialenosti pozdĺž mikrotrubičiek bez odpojenia, čím sa stávajú vysoko efektívnymi transportérmi v preplnenej bunke. Presná regulácia aktivity kinesínu je kľúčová pre udržanie bunkovej homeostázy a funkcie.
Kinesínové motorové proteíny sú nielen základné pre normálne bunkové operácie, ale sú tiež zapojené do rôznych chorôb. Defekty vo funkcii kinesínu boli spojené s neurodegeneratívnymi poruchami, ako je Alzheimerova choroba a dedičná spastická paraplegia, ako aj s určitými rakovinami. Výsledkom je, že kinesíny sú predmetom intenzívneho výskumu, aby sa porozumelo ich základnej biológii a preskúmali ich potenciál ako terapeutické ciele.
Výskum kinesínových motorových proteínov je podporovaný a pokrok dosahujú vedúce vedecké organizácie a výskumné inštitúcie po celom svete, vrátane Národných inštitútov zdravotníctva a Národnej vydavateľskej skupiny, ktoré pravidelne publikujú recenzované štúdie o štruktúre, funkcii a biomedicínskej dôležitosti týchto proteínov. Neustály štúdium kinesínov naďalej odhaľuje nové pohľady na molekulárne stroje života a ponúka sľubné cesty pre vývoj nových zdravotníckych intervencií.
Molekulárna štruktúra a mechanizmus pôsobenia
Kinesínové motorové proteíny sú superrodinou ATP-závislých molekulárnych motorov, ktoré hrajú kľúčovú úlohu v intracelulárnom transporte, najmä pozdĺž mikrotrubičkových dráh. Štrukturálne sa kinesíny typicky skladajú z dvoch ťažkých reťazcov a dvoch ľahkých reťazcov, čím tvoria heterotetramérny komplex. Ťažké reťazce obsahujú vysoko konzervovaný N-terminálny motorový domén (tiež nazývaný „hlava“), špirálovo-vlákno držia a C-terminálny chvostový domén. Motorový domén je zodpovedný za viazanie na mikrotrubičky a hydrolýzu ATP, čo poskytuje energiu potrebnú na pohyb. Naopak, chvostový domén sa podieľa na rozpoznávaní a viazaní nákladu, často interagujúc s adaptačnými proteínmi alebo priamo s vezikulami a organelami.
Mechanizmus pôsobenia kinesínových motorových proteínov je často opísaný ako pohyb „ruka nad rukou“. Každý kinesínový molekul má dva motorové domény, ktoré sa striedavo viažu a uvoľňujú z mikrotrubičky, koordinované viazaním a hydrolýzou ATP. Keď sa jedna hlava viaže na mikrotrubičku a hydrolýzuje ATP, prechádza konformačnou zmenou, ktorá poháňa druhú hlavu dopredu k nasledujúcemu viazaniu, približne 8 nanometrov ďaleko. Tento proces sa opakuje, čo umožňuje kinesínu „chodiť“ jednosmerne pozdĺž mikrotrubičky, zvyčajne smerom k plusovému koncu, ktorý je orientovaný k periférii bunky. Koordinovaná akcia dvoch hláv zabezpečuje procesivitu, čo znamená, že kinesín môže vykonať mnoho krokov pozdĺž mikrotrubičky bez odpojenia, čo je nevyhnutné pre efektívny transport nákladu na dlhé vzdialenosti v bunke.
Kinesíny sú veľmi rozmanité, s viac ako 40 rôznymi kinesínovými génmi identifikovanými u ľudí, pričom každý sa prispôsobuje na špecifické bunkové funkcie. Zatiaľ čo väčšina kinesínov sa pohybuje smerom k plusovému koncu mikrotrubičiek, niektoré, ako členovia rodiny kinesín-14, sa pohybujú smerom k mínusovému koncu, čím zvýrazňujú funkčnú rozmanitosť tejto proteínovej rodiny. Aktivita a smerovanie kinesínov sú určené jemnými rozdielmi v ich motorových doménach a prislúchajúcich regulačných oblastiach.
Štúdium štruktúry a funkcie kinesínu pokročilo pomocou vysoce rozlíšiteľných techník, ako sú röntgenová krystalografia a kryo-elektrónová mikroskopia, ktoré odhalili podrobné pohľady na konformačné zmeny, ktoré ležia v základe ich pohyblivosti. Tieto zistenia sú zásadné pre pochopenie nielen základnej bunkovej biológie, ale aj molekulárneho základu chorôb spojených s dysfunkciou kinesínu, ako sú určité neurodegeneratívne poruchy a rakoviny. Vedúce výskumné organizácie, vrátane Národných inštitútov zdravotníctva a Európske laboratórium molekulárnej biológie, naďalej vyšetrujú molekulárne mechanizmy kinesínových motorových proteínov, zdôrazňujúc ich základný význam v bunkovej biológii.
Hydrolýza ATP a konverzia energie
Kinesínové motorové proteíny sú nevyhnutné molekulárne stroje, ktoré konvertujú chemickú energiu na mechanickú prácu, čo umožňuje transport rôznych bunkových nákladov pozdĺž mikrotrubičiek. Základný proces ležiaci za týmto pohybom je hydrolýza adenosíntrifosfátu (ATP), ktorá poskytuje energiu potrebnú na konformačné zmeny kinesínu a smerový pohyb.
Hydrolýza ATP prebieha na motorových doménach (tiež nazývaných „hlavy“) diméru kinesínu. Každá hlava obsahuje vysoko konzervovanú viazací miesto pre nukleotid, ktoré striedavo viaže a hydrolýzuje ATP. Mechanochemický cyklus začína, keď sa jedna hlava kinesínu, pevne viazaná na mikrotrubičku, viaže ATP. Toto viazanie indukuje konformačnú zmenu v oblasti prepojky krku, ktorá posúva za sebou idúcu hlavu dopredu v pohybe „ruka nad rukou“. Keď sa vedúca hlava viaže na nasledujúcu tubulínovú subjednotku, ATP sa hydrolýzuje na adenosín-difosfát (ADP) a anorganický fosfát (Pi), čo uvoľňuje energiu, ktorá sa prenáša do mechanického pohybu. Uvoľnenie Pi a následná výmena ADP za ATP resetujú cyklus, čo umožňuje kontinuitu procesívneho pohybu pozdĺž mikrotrubičky.
Efektivita konverzie energie v kinesíne je pozoruhodná. Každá molekula ATP, ktorá je hydrolizovaná, vedie k 8-nanometrovému kroku pozdĺž mikrotrubičky s minimálnymi stratami energie. Táto vysoká efektivita je pripisovaná tesnému prepojeniu medzi hydrolýzou ATP a mechanizmom krokového pohybu. Proces je vysoko regulovaný, čím sa zabezpečuje, že hydrolýza ATP sa vyskytuje iba vtedy, keď je hlava kinesínu správne zapojená s mikrotrubičkou, čím sa zabraňuje zbytočnej spotrebe energie.
ATPázová aktivita kinesínu je tiež modifikovaná prítomnosťou nákladu a špecifickým typom člena rodiny kinesínov, ktorý je zapojený. Napríklad, konvenčný kinesín-1 je silne procesívny, schopný vykonať stovky krokov bez odpojenia od mikrotrubičky, zatiaľ čo iné členovia rodiny kinesínov môžu mať rôznu rýchlosť hydrolýzy ATP a chovanie krokov, ktoré sú prispôsobené ich bunkovým funkciám.
Štúdium hydrolýzy ATP a konverzie energie v kinesíne bolo kľúčové pre pochopenie intracelulárnych transportných mechanizmov a širších princípov funkcie molekulárnych motorov. Výskum v tejto oblasti je podporovaný vedúcimi vedeckými organizáciami, ako sú Národné inštitúty zdravia a Národná nadácia pre vedu, ktoré financujú vyšetrovania v oblasti štrukturálnej biológie a biophyziky motorových proteínov. Zistenia získané z týchto štúdií majú dôsledky pre neurobiológiu, bunkové delenie a vývoj nanotechnologických aplikácií, ktoré napodobňujú biologické motory.
Rozpoznávanie nákladu a viazanie špecifickosti
Kinesínové motorové proteíny sú nevyhnutné molekulárne stroje, ktoré transportujú široké spektrum intracelulárnych nákladov pozdĺž dráh mikrotrubičiek, pričom zohrávajú kľúčovú úlohu v procesoch, ako je umiestnenie organel, transport vezikúl a mitóza. Špecifickosť, s ktorou kinesíny rozpoznávajú a viažu svoj náklad, je základná pre vernosť a reguláciu intracelulárneho transportu. Táto špecifickosť je dosahovaná kombináciou štrukturálnych charakteristík, adaptačných proteínov a regulačných mechanizmov.
Superrodina kinesínov je charakterizovaná konzervovaným motorovým doménom zodpovedným za hydrolýzu ATP a viazanie na mikrotrubičky, ale funkcie rozpoznávania a viazania nákladu sú primárne sprostredkované variabilnými chvostovými doménami. Tieto chvostové oblasti sa medzi členmi rodiny kinesínov významne líšia, čo umožňuje selektívnu interakciu s rôznymi nákladmi. Napríklad, kinesín-1 (tiež známy ako konvenčný kinesín) využíva svoj C-terminálny chvost na viazanie mnohých nákladov, vrátane organel viazaných na membráne a vezikúl, často prostredníctvom adaptačných proteínov ako sú kinesínové svetelné reťazce (KLCs). KLCs obsahujú tetratricopeptide repeat (TPR) motívy, ktoré uľahčujú rozpoznávanie špecifických niekoľko proteínov asociovaných s nákladom, čím zabezpečuje selektivitu pre transportný proces.
Adaptačné proteíny zohrávajú kľúčovú úlohu v prepájaní kinesínov s ich nákladmi. Tieto adaptory môžu rozpoznať špecifické signály alebo motívy na povrchu nákladu, čím sa zabezpečuje, že len príslušný náklad je transportovaný daným kinesínom. Napríklad interakcia medzi KLCs a členmi rodiny JIP (c-Jun N-terminal kinase-interacting protein) je dobre zdokumentovaná v neurónovom transporte, kde JIPs fungujú ako lešení prepájajúce kinesín-1 s vezikulami obsahujúcimi signálne molekuly. Iné členovia rodiny kinesínov, ako kinesín-3, využívajú rôzne adaptory a štruktúry chvostových domén, aby dosiahli špecifickosť nákladu, čo odráža rozmanitosť nákladov a bunkových kontextov, v ktorých kinesíny pôsobia.
Regulácia viazania nákladu je tiež dosahovaná prostredníctvom posttranslačných modifikácií a konkurenčných interakcií. Fosforylácia chvostových oblastí kinesínu alebo adaptačných proteínov môže modifikovať afinitu viazania, čo umožňuje dynamické ovládanie nad pripojením a uvoľnením nákladu v reakcii na bunkové signály. Okrem toho môžu niektoré náklady súťažiť o viazanie na rovnaký kinesín, čím sa zavádza ďalšia úroveň regulácie, ktorá zabezpečuje správne rozdelenie nákladu.
Štúdium rozpoznávania nákladu a viazania špecifickosti v kinesínových motorových proteínoch je rýchlo sa rozvíjajúca oblasť, s dôsledkami na pochopenie neurodegeneratívnych chorôb, porúch intracelulárneho transportu a vývoj cieľovej terapie. Vedúce výskumné organizácie ako Národné inštitúty zdravotníctva a Európska organizácia molekulárnej biológie podporujú prebiehajúce vyšetrovania molekulárnych mechanizmov, ktoré ležia za interakciami kinesín-náklad, čím zdôrazňujú biomedicínsky význam tejto oblasti.
Intracelulárne transportné dráhy
Kinesínové motorové proteíny sú nevyhnutné molekulárne stroje, ktoré poháňajú intracelulárny transport pozdĺž mikrotrubičkových dráh, zabezpečujúc presné dodanie organel, vezikúl, proteínov a iných nákladov vo eukaryotických bunkách. Tieto ATP-závislé motory sú charakterizované svojou schopnosťou konvertovať chemickú energiu na mechanickú prácu, čo uľahčuje pohyb bunkových komponentov na veľké vzdialenosti s pozoruhodnou smerovosťou a špecifickosťou.
Štrukturálne sa kinesíny typicky skladajú z dvoch ťažkých reťazcov tvoriacich dimer, pričom každý má globulárny motorový domén (hlava), ktorý sa viaže na mikrotrubičky a hydrolýzuje ATP. Chvostové domény sú zodpovedné za rozpoznávanie a viazanie nákladu, často v spolupráci so svetelnými reťazcami alebo adaptačnými proteínmi. Najviac študovaný člen, kinesín-1, sa pohybuje predovšetkým k plusovému koncu mikrotrubičiek, ktorý zvyčajne zodpovedá periférii bunky, čím zohráva kľúčovú úlohu v anterográdnom transporte.
Mechanizmus pohybu kinesínu je často opísaný ako „ruka nad rukou“ chôdza, kde sa dva motorové domény striedavo viažu a posúvajú pozdĺž mriežky mikrotrubičiek. Každý krok je pevne spojený s hydrolýzou jednej molekuly ATP, čím sa zabezpečuje procesivita a smerovosť. Tento koordinovaný pohyb umožňuje kinesínom transportovať náklady na vzdialenosti, ktoré môžu pokrývať celú dĺžku neurónu alebo iných veľkých typov buniek.
Kinesíny sú klasifikované do viacerých rodín na základe sekvenčnej homológie a funkčnej špecializácie. Zatiaľ čo kinesín-1 je primárne zapojený do transportu organel a vezikúl, iné rodiny, ako kinesín-2 a kinesín-3, majú odlišné úlohy v transportne cilií a synaptických vezikúl. Niektoré kinesíny, ako kinesín-5, sú zapojené do dynamiky mitotických vretení namiesto transportu nákladu, čo vyzdvihuje funkčnú rozmanitosť v rámci tejto superrodiny proteínov.
Aktivita motorov kinesínov je presne regulovaná bunkovými signálnymi dráhami, posttranslačnými modifikáciami a interakciami s mikrotrubičkovými asociačnými proteínmi. Táto regulácia zabezpečuje, že náklady sú dodávané na správne subcelulárne lokácie v reakcii na fyziologické potreby. Rušenie kinesínom sprostredkovaného transportu bolo zapojené do rôznych ochorení, vrátane neurodegeneratívnych ochorení, kde defektný axonálny transport prispieva k dysfunkcii neurónov a degenerácii.
Výskum kinesínových motorových proteínov naďalej zvyšuje naše chápanie celulárnej logistiky a inšpiroval vývoj biomimetických nanodevíz. Vedúce vedecké organizácie, ako sú Národné inštitúty zdravia a Národná vydavateľská skupina, pravidelne publikujú základné štúdie a prehľady o štruktúre, funkcii a biomedicínskej dôležitosti kinesínových motorov, zdôrazňujúc ich centrálne miesto v bunkovej biológii.
Regulácia aktivity kinesínu
Kinesínové motorové proteíny sú nevyhnutné molekulárne stroje, ktoré transportujú náklady pozdĺž mikrotrubičiek vo eukaryotických bunkách. Regulácia aktivity kinesínu je kľúčová pre udržanie organizácie buniek, zabezpečenie správneho rozdelenia organel a podporu procesov, ako sú mitóza a neurónová funkcia. Existuje viacero vrstiev regulácie, ktoré kontrolujú, kedy, kde a ako kinesíny interagujú so svojím nákladom a mikrotrubičkovými dráhami.
Jedným z hlavných mechanizmov regulácie je autoinhibícia. Mnohé členovia rodiny kinesínov, ako kinesín-1, majú chvostové domény, ktoré sa môžu ohnúť späť a interagovať so svojimi motorovými doménami, čím bránia ATPázovej aktivite a viazaniu na mikrotrubičky v neprítomnosti nákladu. Táto autoinhibovaná konformácia sa uvoľňuje po viazaní nákladu, čo indukuje konformačnú zmenu, ktorá aktivuje motor pre procesívny pohyb. Tento mechanizmus zabezpečuje, že kinesíny sú aktívne len vtedy, keď sú potrebné, čím zabraňujú zbytočnej spotrebe ATP a potenciálnemu poškodeniu bunky.
Posttranslačné modifikácie (PTMs) zohrávajú tiež významnú úlohu v modulácii aktivity kinesínu. Fosforylácia je najviac skúmanou PTM, pričom kinázy ako cyklín-dependentné kinázy (CDKs) a kináza glykogénovej syntázy 3 (GSK3) fosforylujú špecifické zvyšky na proteínoch kinesínu. Tieto modifikácie môžu buď posilniť, alebo inhibovať motorovú aktivitu, v závislosti od kontextu a špecifického kinesínu. Napríklad, fosforylácia kinesínu-1 zo strany GSK3 inhibuje jeho schopnosť viazať mikrotrubičky, čím reguluje axonálny transport v neurónoch.
Adaptačné proteíny pre náklad ďalej spresňujú reguláciu kinesínu. Tieto adaptory, ako JIP1 a Milton, prepájajú kinesíny so špecifickými nákladmi a môžu modulovať motorovú aktivitu stabilizovaním aktívnej konformácie alebo prijímaním ďalších regulačných faktorov. Interakcie medzi adaptormi a motormi umožňujú presné priestorové a časové riadenie dodávania nákladu, čo je zvlášť kritické v vysoce polarizovaných bunkách, akými sú neuróny.
Okrem toho môžu samotné mikrotrubičkové dráhy ovplyvniť aktivitu kinesínu. Proteíny viažuce sa na mikrotrubičky (MAPs) a posttranslačné modifikácie tubulínu (ako acetylácia alebo detyrozinačná) môžu zmeniť afinitu viazania a pohyblivosť kinesínov, čím efektívne usmerňujú alebo obmedzujú ich pohyb pozdĺž špecifických podmnožín mikrotrubičiek.
Regulácia motorových proteínov kinesínov je predmetom prebiehajúceho výskumu, s dôsledkami pre pochopenie neurodegeneratívnych chorôb, rakoviny a vývojových porúch. Vedúce organizácie ako Národné inštitúty zdravia a Národná vydavateľská skupina podporujú a šíria výskum v tejto oblasti, pričom zdôrazňujú dôležitosť regulácie kinesínu v zdraví a chorobách.
Kinesín v neurónovej funkcii a axonálnom transporte
Kinesínové motorové proteíny sú superrodinou ATP-závislých molekulárnych motorov, ktoré zohrávajú rozhodujúcu úlohu v intracelulárnom transporte, najmä v extrémne polarizovanom prostredí neurónov. Tieto proteíny sa pohybujú pozdĺž mikrotrubičkových dráh, konvertujúc chemickú energiu z hydrolýzy ATP na mechanickú prácu, ktorá umožňuje smerovaný pohyb rôznych bunkových nákladov. V neurónoch sú kinesíny nevyhnutné pre transport organel, prekurzorov synaptických vezikúl, proteínov a mRNA z bunkového tela (soma) k axonálnemu terminálu, proces známy ako anterográdny axonálny transport.
Superrodina kinesínov je rozmanitá, s viac ako 40 rôznymi kinesínovými génmi identifikovanými u ľudí, pričom každý kóduje proteíny so špecializovanými funkciami a špecifickosťami nákladu. Najviac charakterizovaný člen, kinesín-1 (tiež známy ako konvenčný kinesín), je heterotetramér pozostávajúci z dvoch ťažkých reťazcov a dvoch ľahkých reťazcov. Ťažké reťazce obsahujú motorové domény zodpovedné za hydrolýzu ATP a viazanie na mikrotrubičky, zatiaľ čo ľahké reťazce sprostredkúvajú rozpoznávanie a viazanie nákladu. Táto štruktúrna organizácia umožňuje kinesínu-1 transportovať širokú škálu nákladov, ktoré sú kľúčové pre neurónovú funkciu a prežitie.
Axonálny transport je nevyhnutný pre udržanie zdravia a funkcie neurónov, keďže niektoré axóny môžu rozťahovať až na meter u ľudí. Anterográdny transport poháňaný kinesínmi zabezpečuje včasné dodávanie synaptických komponentov, mitochondrií a iných základných organel do distálnych oblastí neurónu. Rušenie funkcie kinesínu môže viesť k defektom v synaptickej prenose, axonálnej degenerácii a bolo zapojené do niekoľkých neurodegeneratívnych chorôb, vrátane Alzheimerovej choroby a amyotrofickej laterálnej sklerózy (ALS). Dôležitosť kinesínmi sprostredkovaného transportu v neurónovom zdraví je zdôraznená výskumom od vedúcich vedeckých organizácií, ako sú Národné inštitúty zdravia a Národný inštitút neurologických porúch a mŕtvice, ktoré poukázali na spojitosť medzi defektmi axonálneho transportu a neurodegeneráciou.
Okrem anterográdneho transportu koordinujú kinesíny aj s dyneínom motorovými proteínmi, ktoré sprostredkovavajú retrográdny transport (z axonálneho terminálu späť do soma), aby udržali obojsmerný tok materiálov potrebných pre neurónovú homeostázu. Presná regulácia aktivity kinesínu, výber nákladu a koordinácia s inými motorovými proteínmi sú predmetom prebiehajúceho výskumu, majúc dôsledky pre pochopenie molekulárneho základu neurónového prepojenia, plasticity a chorôb.
Porovnávacia analýza: Kinesín verzus dyneín a myozín
Kinesínové motorové proteíny sú základnou triedou molekulárnych motorov, ktoré zohrávajú kľúčovú úlohu v intracelulárnom transporte, najmä pozdĺž mikrotrubičkových dráh. Pre plné ocenenie ich biologického významu je nevyhnutné porovnať kinesíny s ďalšími dvoma hlavnými rodinami cytoskeletálnych motorových proteínov: dyneínmi a myozínmi. Každý z týchto motorových proteínov je špecializovaný na pohyb pozdĺž odlišných cytoskeletálnych filament a je prispôsobený na konkrétne bunkové funkcie.
Kinesíny a dyneíny obaja prechádzajú mikrotrubičkami, ale líšia sa svojou smerovosťou a špecifickosťou nákladu. Kinesíny sa zvyčajne pohybujú smerom k plusovému koncu mikrotrubičiek, ktorý je zvyčajne orientovaný k periférii bunky, čím uľahčujú anterográdny transport organel, vezikúl a proteínových komplexov. Naopak, dyneíny sa pohybujú smerom k mínusovému koncu mikrotrubičiek, smerujúc náklad k centru bunky, ako je jadro alebo organizujúce centrum mikrotrubičiek. Tento obojsmerný systém zabezpečuje efektívny rozvod a recykláciu bunkových komponentov. Štrukturálne sú kinesíny typicky homodimérne alebo heterodimérne proteíny s dvoma motorovými doménami, zatiaľ čo cytoplazmatické dyneíny sú veľké, multi-subjednotkové komplexy s zložitejším mechanizmom generovania sily a regulácie (Národný inštitút genetiky).
Myozín a na druhej strane sú primárne motorové proteíny založené na aktíne. Sú najlepšie známe pre svoju úlohu v svalovej kontrakcii, ale tiež sa zúčastňujú na rôznych nemuskulárnych bunkových procesoch, ako sú cytokinezá, transport vezikúl a bunková mobilita. Na rozdiel od kinesínov a dyneínov, ktoré sa pohybujú pozdĺž mikrotrubičiek, myozíny prechádzajú aktínovými filamentami, zvyčajne smerom k plus (barbovému) koncu. Štrukturálna organizácia myozínov je odlišná, s charakteristickou hlavou domény, ktorá sa viaže na aktín a hydrolýzuje ATP, región krku a chvost, ktorý určuje špecifickosť nákladu (Národné inštitúty zdravia).
Funkčne sú tri rodiny motorových proteínov prispôsobené svojim príslušným cytoskeletálnym dráham a bunkovým úlohám. Kinesíny sú kľúčové pre dlhé, smerové transporty v neurónoch a deliacich sa bunkách, zatiaľ čo dyneíny sú nevyhnutné pre retrográdny transport a pohyb cilií/flagiel. Myozíny, naopak, sú centrálne pre procesy vyžadujúce generovanie sily a krátke vzdialenosti transportu na aktínových sieťach. Interakcia medzi týmito motormi zabezpečuje dynamickú organizáciu a prispôsobivosť eukaryotickej bunky.
Na záver, zatiaľ čo kinesíny, dyneíny a myozíny zdieľajú základnú vlastnosť konvertovania chemickej energie z hydrolýzy ATP na mechanickú prácu, sú špecializované na rôzne dráhy, smery a bunkové funkcie. Ich koordinované akcie sú kľúčové pre udržanie bunkovej architektúry, signálov a homeostázy.
Choroby spojené s kinesínmi a terapeutické ciele
Kinesínové motorové proteíny sú nevyhnutné molekulárne stroje, ktoré transportujú rôzne bunkové náklady pozdĺž mikrotrubičiek, pričom zohrávajú kľúčovú úlohu v intracelulárnej doprave, mitóze a neurónovej funkcii. Dysregulácia alebo mutácia kinesínových génov bola zapojená do radu ľudských ochorení, čo tieto proteíny robí významnými ako biomarkery aj ako potenciálne terapeutické ciele.
Jedno z najlepšie zdokumentovaných ochorení, ktoré sú s tým spojené, zahŕňa člena rodiny kinesínov KIF1A. Mutácie v KIF1A géne sú spojené so spektrom neurodegeneratívnych porúch, kolektívne nazývaných KIF1A-asociovaná neurologická porucha (KAND). Tieto podmienky sa prejavujú ako duševná nepríčetnosť, spastická paraplegia a progresívna neurodegenerácia. Základná patológia je často pripisovaná zhoršenému axonálnemu transportu, ktorý narušuje synaptickú funkciu a prežitie neurónov. Podobne, mutácie v iných kinesínových génoch, ako KIF5A a KIF21A, sú spojené s dedičnou spastickou paraplegiou a kongenitálnou fibrózou extraokulárnych svalov, čím ďalej posilňujú kritickú úlohu kinesínov v zdraví nervového systému.
Okrem neurodegenerácie sú kinesínové motorové proteíny zapojené aj do rakoviny. Napríklad KIF11 (tiež známy ako Eg5) je nevyhnutný pre tvorbu mitotického vretena počas delenia buniek. Prekročenie alebo hyperaktivita KIF11 bola pozorovaná v rôznych rakovinách, uključujúc rakovinu prsníka a prostaty, kde prispieva k nekontrolovanej proliferácii buniek. Výsledkom je, že KIF11 sa stal sľubným cieľom pre protivírusové dragové terapie. Niekoľko malých molekulárnych inhibítorov KIF11, ako ispinesib, sa dostalo do klinického výskumu, snažiac sa selektívne narušiť delenie rakovinových buniek, pričom šetria normálne bunky. Vývoj a hodnotenie týchto inhibítorov sú starostlivo monitorované regulačnými a výskumnými organizáciami, ako je Národný onkologický inštitút a Úrad pre reguláciu potravín a liečiv.
Terapeutické stratégií, ktoré cTargetujú kinesínové motorové proteíny, presahujú onkológiu. V neurodegeneratívnych chorobách sa vedú snahy vyvinúť molekuly, ktoré môžu obnoviť alebo modulovať funkciu kinesínu, čo by potenciálne zlepšilo deficity axonálneho transportu. Navyše výskum podporovaný organizáciami, ako sú Národné inštitúty zdravia, skúma génovú terapiu a malé molekulárne prístupy na opravu alebo kompenzáciu za defektnú aktivitu kinesínu v genetických poruchách.
Na záver, kinesínové motorové proteíny sú centrálne pre bunkové zdravie a ich dysfunkcia je spojená s radom ochorení, najmä v nervovom systéme a pri rakovine. Prebiehajúci výskum a klinické vývojové snahy naďalej skúmajú kinesíny ako biomarkery a terapeutické ciele, s potenciálom poskytnúť nové liečby pre aktuálne nevyliečiteľné stavy.
Nové výskumy a budúce smery
Nové výskumy na kinesínových motorových proteínoch rýchlo rozširujú naše chápanie ich rolí v bunkových procesoch a potenciálnych aplikácií v biotechnológii a medicíne. Kinesíny sú superrodinou ATP-závislých molekulárnych motorov, ktoré transportujú náklad pozdĺž mikrotrubičiek, pričom zohrávajú zásadné úlohy v intracelulárnej doprave, mitóze a neurónovej funkcii. Nedávne pokroky v vysokorozlíšiteľnej imagine a fyzike jedného molekuly umožnili výskumníkom vizualizovať dynamiku kinesínov v bezprecedentnom detaile, odhaľujúc nové pohľady na ich mechanochemické cykly a regulačné mechanizmy.
Jedným sľubným smerom je objasnenie štrukturálnej rozmanitosti kinesínu a jej dôsledkov pre špecifickosť a reguláciu nákladu. Techniky štrukturálnej biológie, ako je kryo-elektrónová mikroskopia, odhalili odlišné konformačné stavy členov rodiny kinesínov, čo naznačuje špecializované prispôsobenia pre rôzne bunkové úlohy. Tieto štrukturálne poznatky informujú dizajn malých molekúl a peptidov, ktoré môžu modulovať aktivitu kinesínu, s potenciálnymi terapeutickými aplikáciami v neurodegeneratívnych chorobách a rakovine, kde je abnormálna funkcia kinesínu zapojená do patogenézy.
Syntezná biológia tiež využíva kinesínové motory na inžinierstvo nanoskalových transportných systémov. Využitím smerového pohybu kinesínov vyvíjajú výskumníci biomimetické zariadenia na cielené dodávanie liekov a molekulárnu zostavu. Tieto inovácie môžu revolučne zmeniť presnú medicínu tým, že umožnia kontrolovaný transport terapeutických činidiel vo vnútri buniek alebo tkanív.
Ďalšou sa rozvíjajúcou oblasťou je štúdium úlohy kinesínu v zdraví a chorobách neurónov. Mutácie v kinesínových génoch boli spojené s dedičnou spastickou paraplegiou, Charcot-Marie-Toothovou chorobou a inými neurodegeneratívnymi poruchami. Prebiehajúci výskum má za cieľ objasniť, ako tieto mutácie narušujú axonálny transport a identifikovať stratégie na obnovenie normálnej funkcie. Národné inštitúty zdravia a Národný inštitút neurologických porúch a mŕtvice podporujú iniciatívy na vyšetrovanie molekulárnych základov týchto ochorení a na vývoj cielených zásahov.
V budúcnosti sa očakáva, že integrácia počítačového modelovania, pokročilej mikroskopie a technológií úpravy genómu urýchli objavy v biológii kinesínu. Spolupráca medzi akademickými inštitúciami, vládnymi agentúrami a biotechnologickými spoločnosťami podporuje prechod základného výskumu do klinických a priemyselných aplikácií. Ako sa naše chápanie kinesínových motorových proteínov prehlbuje, objavia sa nové možnosti pre manipuláciu intracelulárneho transportu, diagnostiku ochorení a navrhovanie inovatívnych terapeutických stratégií.
Zdroje a odkazy
- Národné inštitúty zdravotníctva
- Národná vydavateľská skupina
- Európske laboratórium molekulárnej biológie
- Národná nadácia pre vedu
- Európska organizácia molekulárnej biológie
- Národný inštitút genetiky
- Národný onkologický inštitút