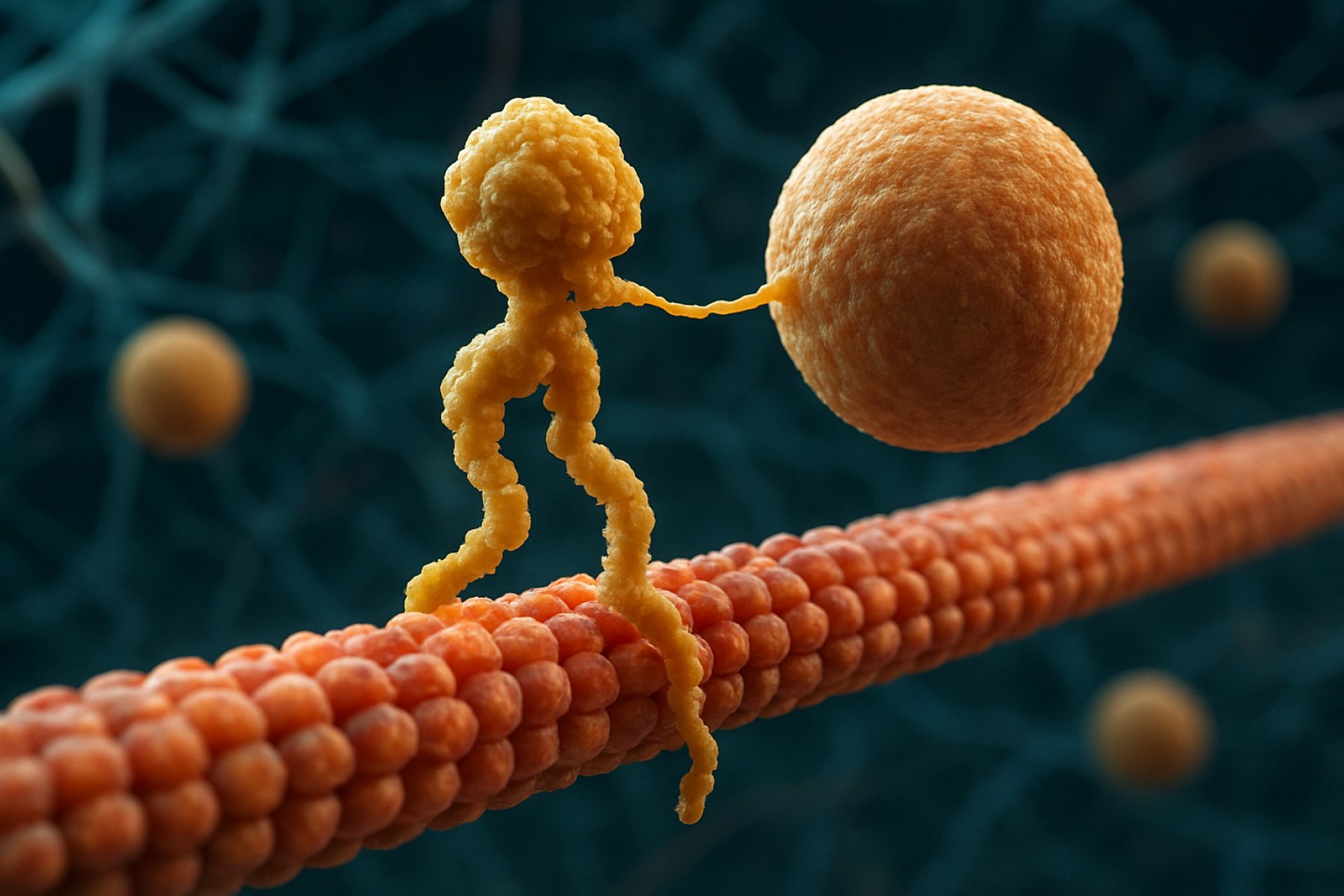
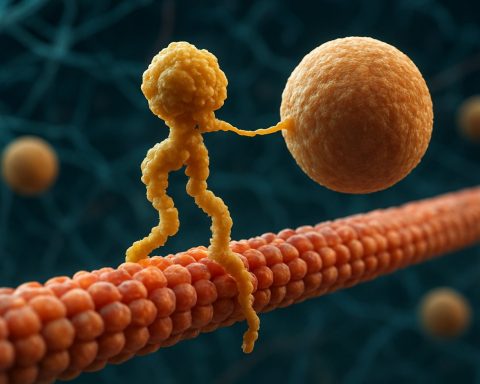
Kinezinske motorne beljakovine: Dinamični stroji, ki poganjajo intracelularno logistiko. Odkrijte, kako te molekularne naprave revolucionirajo celično delovanje in zdravje.
- Uvod v kinezinske motorne beljakovine
- Molekularna struktura in mehanizem delovanja
- Hidroliza ATP in pretvorba energije
- Prepoznavanje tovora in specifičnost vezave
- Intracelularne transportne poti
- Regulacija aktivnosti kinezina
- Kinesin v nevronalni funkciji in aksonalnem transportu
- Konstrukcijska analiza: Kinesin proti dyneinu in miozinu
- Bolezni, povezane s kinezini, in terapevtski cilji
- Nadobudne raziskave in prihodnje smeri
- Viri in reference
Uvod v kinezinske motorne beljakovine
Kinezinske motorne beljakovine so temeljna klas molekularnih motorjev, ki igrajo ključno vlogo pri intracelularnem transportu in organizaciji celic. Odkrite v sredini 80-ih let, so kinezini beljakovine, odvisne od ATP, ki se gibljejo po mikrocevkah znotraj evkariontskih celic in prenašajo različne tovore, kot so organeli, vezikli, beljakovine in mRNA. Ta transport je ključen za številne celične procese, vključno z mitozo, meiozo in nevronalno funkcijo. Superfamilija kinezina je velika in raznolika, saj je bilo v človeškem genoma identificiranih več kot 40 različnih kinezinskih genov, pri čemer vsak kodira beljakovine s specifičnimi funkcijami in specifičnostmi tovora.
Strukturno so kinezini običajno sestavljeni iz dveh težkih verig in dveh lahkih verig. Težke verige vsebujejo ohranjeno motorno domeno, ki se veže na mikrocevkah in hidrolizira ATP za generiranje gibanja. Repne domene kinezina so odgovorne za vezavo tovora, kar omogoča motorju, da preseli specifične celične komponente na njihova predvidena mesta. Gibanje kinezina je običajno usmerjeno proti plus koncu mikrocevk, kar običajno pomeni celico obrobje, čeprav se nekateri člani družine kinezina gibljejo proti minus koncu.
Mehanizem gibanja kinezina pogosto opisujejo kot “ročni-preko-ročne” gibanje, kjer se dve motorni domeni izmenično vežeta in sproščata mikrocevk, napajane s cikli vezave in hidrolize ATP. Ta procesivno gibanje omogoča kinezinu, da se dolge razdalje premika po mikrocevkah, ne da bi se od njih odvzel, kar jih dela izjemno učinkovite prevoznike znotraj gneče celičnega okolja. Natančna regulacija aktivnosti kinezina je odločilna za vzdrževanje celične homeostaze in delovanja.
Kinezinske motorne beljakovine niso le bistvene za normalno delovanje celic, temveč so tudi implicirane v različnih boleznih. Napake v delovanju kinezina so bile povezane z nevrodegenerativnimi motnjami, kot sta Alzheimerjeva bolezen in dedna spastična paraplegija, pa tudi nekatere vrste raka. Kot rezultat, so kinezini predmet intenzivnih raziskav, tako za razumevanje njihove osnovne biologije kot za raziskovanje njihove potencialne vloge kot terapevtski cilji.
Raziskave o kinezinskih motornih beljakovinah podpirajo in napredujejo vodilne znanstvene organizacije in raziskovalni instituti po vsem svetu, vključno z Nacionalnimi institucijami za zdravje in Nature Publishing Group, ki redno objavljajo pregledne študije o strukturi, funkciji in biomedicinskem pomenu teh beljakovin. Nadaljnje raziskave kinezina še naprej razkrivajo nove vpoglede v molekularne mehanizme življenja in ponujajo obetavne možnosti za razvoj novih medicinskih intervencij.
Molekularna struktura in mehanizem delovanja
Kinezinske motorne beljakovine so superfamilija ATP-odvisnih molekularnih motorjev, ki igrajo ključno vlogo pri intracelularnem transportu, predvsem po mikrocevkah. Strukturno se kinezini običajno sestavljajo iz dveh težkih verig in dveh lahkih verig, ki tvorijo heterotetramerski kompleks. Težje verige vsebujejo močno ohranjeno N-terminalno motorno domeno (tudi imenovano “glava”), zavito steblo in C-terminalno repno domeno. Motorna domena je odgovorna za vezavo mikrocevk in hidrolizo ATP, kar zagotavlja energijo potrebno za gibanje. Repna domena je v nasprotju povezana z prepoznavanjem in vezavo tovora, pogosto v interakciji z adapterji ali neposredno z vezikli in organeli.
Mehanizem delovanja kinezinskih motornih beljakovin pogosto opisujejo kot “ročni-preko-ročne” gibanje. Vsaka molekula kinezina ima dve motorni domeni, ki se izmenično vežeta in sproščata z mikrocevk, usklajeni s vezavo in hidrolizo ATP. Ko se ena glava veže na mikrocevk in hidrolizira ATP, pride do konformacijske spremembe, ki potisne drugo glavo naprej do naslednjega veznega mesta, približno 8 nanometrov stran. Ta postopek se ponavlja, kar omogoča kinezinu, da “hodi” enosmerno po mikrocevkah, običajno proti plus koncu, ki je usmerjen proti celici obrobju. Usklajeno delovanje dveh glav zagotavlja procesivnost, kar pomeni, da kinezini lahko opravijo mnoge korake po mikrocevkah, ne da bi se od njih odlepili, kar je bistveno za učinkovito prevoz tovora na dolge razdalje znotraj celice.
Kinezini so zelo raznoliki, z več kot 40 različnimi kinezinskimi geni, identificiranimi pri ljudeh, pri čemer je vsak prilagojen za specifične celične funkcije. Medtem ko se večina kinezina giblje proti plus koncu mikrocevk, nekateri, kot so člani družine kinezina-14, se gibljejo proti minus koncu, kar poudarja funkcionalno vsestranskost te družine beljakovin. Aktivnost in usmerjenost kinezina določajo subtilne razlike v njihovih motornicah in povezanih regulativnih območjih.
Raziskovanje strukture in funkcije kinezina je napredovalo z visokoločljivostnimi tehnikami, kot sta rentgenska kristalografija in krio-elektronska mikroskopija, ki so razkrile podrobne vpoglede v konformacijske spremembe, ki so osnova njihove gibljivosti. Ti izsledki so bili ključni ne le za razumevanje osnovne celične biologije, temveč tudi za molekularne osnove bolezni povezane z disfunkcijo kinezina, kot so nekatere nevrodegenerativne bolezni in rak. Vodilne raziskovalne organizacije, vključno z Nacionalnimi institucijami za zdravje in Evropskim laboratorijem za molekularno biologijo, še naprej razkrivajo molekularne mehanizme motoričnih beljakovin kinezina, kar poudarja njihovo ključno vlogo v celični biologiji.
Hidroliza ATP in pretvorba energije
Kinezinske motorne beljakovine so bistveni molekularni stroji, ki pretvarjajo kemijsko energijo v mehansko delo, kar omogoča transport različnih celičnih tovora po mikrocevkah. Temeljni proces, ki stoji za tem gibanjem, je hidroliza adenozin trifosfata (ATP), ki zagotavlja energijo, potrebno za konformacijske spremembe in usmerjeno gibljivost kinezina.
Hidroliza ATP poteka na motornicah (tudi imenovanih “glave”) dimera kinezina. Vsaka glava vsebuje visoko ohranjeno mesto za vezavo nukleotidov, ki izmenično veže in hidrolizira ATP. Mehanokemični cikel se začne, ko se ena glava kinezina, trdno vezana na mikrocevk, veže na ATP. Ta vezava povzroči konformacijsko spremembo v predelu povezave med zanko, ki potisne zaostalu glavo naprej v “ročni-preko-ročne” gibanje. Ko se vodilna glava veže na naslednji tubulinski podenoto, se ATP hidrolizira v adenozin difosfat (ADP) in anorganski fosfat (Pi), kar sprosti energijo, ki se prenese v mehansko gibanje. Sprostitev Pi in naslednja izmenjava ADP za ATP ponastavi cikel in omogoči neprekinjeno procesivo gibanja po mikrocevkah.
Učinkovitost pretvorbe energije v kinezinu je izjemna. Vsaka molekula ATP, ki se hidrolizira, rezultira v 8-nanometrskem koraku po mikrocevkah, z minimalno izgubo energije. Ta visoka učinkovitost izhaja iz tesne povezave med hidrolizo ATP in mehanizmom mehaničnega koraka. Postopek je močno reguliran, kar zagotavlja, da hidroliza ATP poteka le, ko se glava kinezina pravilno angažira z mikrocevk, s čimer se preprečuje nepotrebna poraba energije.
ATP-azna aktivnost kinezina je prav tako modulirana s prisotnostjo tovora in specifično vrsto člana družine kinezina. Na primer, konvencionalni kinezín-1 je zelo procesiven, sposoben narediti stotine korakov brez odklopa od mikrocevk, medtem ko imajo drugi člani družine kinezina lahko različne hitrosti hidrolize ATP in obnašanja pri korakih, prilagojene njihovim celičnim funkcijam.
Raziskovanje hidrolize ATP in pretvorbe energije v kinezinu je bilo ključnega pomena za razumevanje intracelularnih transportnih mehanizmov in širših načel delovanja molekularnih motorjev. Raziskave na tem področju podpirajo vodilne znanstvene organizacije, kot so Nacionalni inštituti za zdravje in Nacionalna znanstvena fundacija, ki financirajo preiskave o strukturni biologiji in biofiziki motoričnih beljakovin. Spoznanja, pridobljena iz teh študij, imajo posledice za nevrobiologijo, celično delitev in razvoj nanotehnoloških aplikacij, ki posnemajo biološke motorje.
Prepoznavanje tovora in specifičnost vezave
Kinezinske motorne beljakovine so bistveni molekularni stroji, ki prenašajo široko paleto intracelularnih tovora po mikrocevkah, pri čemer igrajo pomembno vlogo v procesih, kot so pozicioniranje organelov, transport veziklov in mitoza. Specifičnost, s katero kinezini prepoznajo in se vežejo na svoj tovor, je temeljna za zanesljivost in regulacijo intracelularnega transporta. Ta specifičnost se doseže s kombinacijo strukturnih lastnosti, adapternih beljakovin in regulativnih mehanizmov.
Superfamilija kinezina je značilna po ohranjeni motorni domeni, odgovorni za hidrolizo ATP in vezavo mikrocevk, vendar funkcije prepoznavanja in vezave tovora primarno izvajajo spremenljive repne domene. Te repne regije se med člani družine kinezina znatno razlikujejo, kar omogoča selektivno interakcijo z različnimi tovori. Na primer, kinezín-1 (znan tudi kot konvencionalni kinezín) uporablja svojo C-terminalno repno domeno za vezavo na različne tovore, vključno z organeli vezanimi na membrane in vezikli, pogosto preko adapternih beljakovin, kot so lahke kinezinske verige (KLC). KLC vsebujejo tetratricopeptide repeat (TPR) motive, ki olajšajo prepoznavanje specifičnih beljakovin, povezanih s tovorom, s čimer prenašajo selektivnost na proces transporta.
Adapterne beljakovine igrajo ključno vlogo pri povezovanju kinezina s svojimi tovori. Ti adapterji lahko prepoznajo specifične signale ali motive na površini tovora, kar zagotavlja, da se le primeren tovor prevaža po danem kinezinu. Na primer, interakcija med KLC in člani družine JIP (beljakovina, ki sodeluje z jankom N-terminal) je dobro dokumentirana pri nevronalnem transportu, kjer JIP delujejo kot scaffoldi, ki povezujejo kinezín-1 z vezikli, ki vsebujejo signalne molekule. Drugi člani družine kinezina, kot je kinezín-3, uporabljajo različne adapterje in strukture repnih domen za dosego specifičnosti tovora, kar odraža raznolikost tovorov in celičnih kontekstov, v katerih delujejo kinezini.
Regulacija vezave tovora se prav tako doseže preko posttranslacijskih modifikacij in konkurentnih interakcij. Fosforilacija repov kinezina ali adapternih beljakovin lahko modulira afiniteto vezave, kar omogoča dinamično kontrolo nad pritrditvijo in sproščanjem tovora kot odgovor na celične signale. Poleg tega se lahko nekateri tovori med seboj tekmujejo za vezavo na isti kinezín, kar uvaja še eno plast regulacije, ki zagotavlja pravilno distribucijo tovora.
Raziskovanje prepoznavanja tovora in specifičnosti vezave v kinezinskih motoričnih beljakovinah je hitro razvijajoče se področje, ki ima posledice za razumevanje nevrodegenerativnih bolezni, motenj intracelularnega prometa in razvoja ciljnih terapevtskih sredstev. Vodilne raziskovalne organizacije, kot so Nacionalni inštituti za zdravje in Evropska organizacija za molekularno biologijo, podpirajo nadaljnje raziskave o molekularnih mehanizmih interakcij kinezina s tovori, kar poudarja biomedicinski pomen tega področja.
Intracelularne transportne poti
Kinezinske motorne beljakovine so bistveni molekularni stroji, ki poganjajo intracelularni transport po mikrocevkah, s čimer zagotavljajo natančno dostavo organelov, veziklov, beljakovin in drugih tovora znotraj evkariontskih celic. Ti ATP-odvisni motorji so značilni po svoji sposobnosti pretvarjanja kemijske energije v mehansko delo, kar olajša gibanje celičnih komponent na dolge razdalje z izjemno usmerjenostjo in specifičnostjo.
Strukturno se kinezini običajno sestavljajo iz dveh težkih verig, ki tvorita dimer, pri čemer vsaka vsebuje globularno motornu domeno (glava), ki se veže na mikrocevk in hidrolizira ATP. Repne domene so odgovorne za prepoznavanje in vezavo tovora, pogosto v povezavi z lahkimi verigami ali adapternimi beljakovinami. Najbolj raziskovani član, kinezín-1, se prevaža predvsem proti plus koncu mikrocevk, kar ponavadi ustreza celičnemu robu, ter s tem igra ključno vlogo v anterogradnem transportu.
Mehanizem gibanja kinezina pogosto opisujejo kot “ročni-preko-ročne” gibanje, kjer se dve motornici izmenično vežeta in stopajo po mreži mikrocevk. Vsak korak je tesno povezan s hidrolizo ene same molekule ATP, kar zagotavlja procesivnost in usmerjenost. To usklajeno gibanje omogoča kinezinu, da prenaša tovore na razdalje, ki lahko segajo čez celotno dolžino nevrona ali drugih velikih celičnih tipov.
Kinezini se razdelijo v več družin, na podlagi zaporedne homologije in funkcionalne specializacije. Medtem ko je kinezín-1 prvenstveno vključen v transport organelov in veziklov, imajo druge družine, kot sta kinezín-2 in kinezín-3, specifične vloge v ciliarni transport in trafiku sinaptičnih veziklov. Nekateri kinezini, kot je kinezín-5, so vključeni v dinamiko mitotskega vretena namesto transporta tovora, kar poudarja funkcionalno raznolikost znotraj te superfamilije beljakovin.
Aktivnost motorjev kinezina je natančno regulirana s celičnimi signalnimi potmi, posttranslacijskimi modifikacijami in interakcijami z beljakovinami, povezanimi z mikrocevkami. Ta regulacija zagotavlja, da se tovori dostavljajo na pravilne subcelične lokacije v skladu s fiziološkimi potrebami. Motnje pri transportu, ki jih vodijo kinezini, so bile povezane z različnimi boleznimi, vključno z nevrodegenerativnimi motnjami, kjer defektni aksalni transport prispeva k nevronalni disfunkciji in degeneraciji.
Raziskave o kinezinskih motornih beljakovinah še naprej napredujejo naše razumevanje celične logistike in so navdihnile razvoj biomimetičnih nan naprav. Vodilne znanstvene organizacije, kot so Nacionalni inštituti za zdravje in Nature Publishing Group redno objavljajo temeljne študije in preglede o strukturi, funkciji in biomedicinskem pomenu motorjev kinezina ter poudarjajo njihovo osrednjo vlogo pri celični biologiji.
Regulacija aktivnosti kinezina
Kinezinske motorne beljakovine so bistveni molekularni stroji, ki prevažajo tovor po mikrocevkah znotraj evkariontskih celic. Regulacija aktivnosti kinezina je ključna za vzdrževanje celične organizacije, zagotavljanje pravilne distribucije organelov in podporo procesom, kot so mitoza in nevronalna funkcija. Obstoja več plasti regulacije, ki nadzorujejo kdaj, kje in kako se kinezini povezujejo s svojim tovorom in mikrocevkami.
Eden od primarnih mehanizmov regulacije je avto-inhibicija. Mnogi člani družine kinezina, kot je kinezín-1, imajo repne domene, ki se lahko zložijo nazaj in povežejo s svojimi motoričnimi domenami, kar preprečuje ATP-azno aktivnost in vezavo mikrocevk v odsotnosti tovora. Ta avto-inhibitorna konformacija se sprosti ob vezavi tovora, kar sproži konformacijsko spremembo, ki aktivira motor za procesivno gibanje. Ta mehanizem zagotavlja, da so kinezini aktivni le, kadar so potrebni, in tako preprečuje nepotrebno porabo ATP in morebitno celično škodo.
Posttranslacijske modifikacije (PTM) prav tako pomembno vplivajo na modulacijo aktivnosti kinezina. Fosforilacija je najbolj raziskana PTM, pri kateri kinaze, kot so kinaze, odvisne od ciklinov (CDK), in kinaza glikogenskih sintaz, fosforilirajo specifične ostanke na beljakovinah kinezina. Te modifikacije lahko bodisi povečajo bodisi znižajo aktivnost motorjev, odvisno od konteksta in specifičnega kinezina, ki je vključen. Na primer, fosforilacija kinezina-1 s strani GSK3 zmanjšuje njegovo sposobnost vezave na mikrocevk, s čimer se regulira aksalni transport v nevronih.
Beljakovine adapterji tovora dodatno izboljšajo regulacijo kinezina. Ti adapterji, kot sta JIP1 in Milton, povezujejo kinezine s specifičnimi tovori in lahko modulirajo aktivnost motorja, tako da stabilizirajo aktivno konformacijo ali prikličejo dodatne regulativne dejavnike. Medsebojna povezava med adapterji in motorji omogoča natančno prostorsko in časovno kontrolo dostave tovora, kar je še posebej pomembno v močno polariziranih celicah, kot so nevroni.
Poleg tega lahko tudi mikrocevkaste poti same vplivajo na aktivnost kinezina. Beljakovine, povezane z mikrocevkami (MAP) in posttranslacijske modifikacije tubulina (kot sta acetilacija ali detirozinacija) lahko spremenijo afiniteto vezave in gibljivost kinezina, praktično usmerjajoč ali omejevalno njihov gibanje po specifičnih subsetih mikrocevk.
Regulacija motornih beljakovin kinezina je predmet ongoing raziskav, z implikacijami za razumevanje nevrodegenerativnih bolezni, raka in razvojnih motenj. Vodilne organizacije, kot so Nacionalni inštituti za zdravje in Nature Publishing Group, podpirajo in širijo raziskave na tem področju, kar poudarja pomen regulacije kinezina za zdravje in bolezni.
Kinesin v nevronalni funkciji in aksonalnem transportu
Kinezinske motorne beljakovine so superfamilija ATP-odvisnih molekularnih motorjev, ki igrajo ključno vlogo pri intracelularnem transportu, zlasti v močno polariziranem okolju nevronov. Te beljakovine se gibljejo po mikrocevkah in pretvarjajo kemijsko energijo iz hidrolize ATP v mehansko delo, kar omogoča usmerjeno gibanje različnih celičnih tovora. V nevronih so kinezini ključni za transport organelov, prekurzorjev sinaptičnih veziklov, beljakovin in mRNAs z telesa celice (soma) do aksonalne terminale, proces imenovan anterogradni aksalni transport.
Superfamilija kinezina je raznolika, saj je bilo pri ljudeh identificiranih več kot 40 različnih kinezinskih genov, pri čemer vsak kodira beljakovine s specializiranimi funkcijami in specifičnostmi tovora. Najbolj dobro raziskovani član, kinezín-1 (znan tudi kot konvencionalni kinezín), je heterotetramer, sestavljen iz dveh težkih in dveh lahkih verig. Težje verige vsebujejo motorične domene, odgovorne za hidrolizo ATP in vezavo mikrocevk, medtem ko lahke verige posredujejo prepoznavanje in vezavo tovora. Ta strukturna organizacija omogoča kinezinu-1, da prenese široko paleto tovora, ki je ključen za nevronalno delovanje in preživetje.
Aksalni transport je bistven za ohranjanje nevronalnega zdravja in delovanja, glede na ekstremno dolžino nekaterih aksonov, ki lahko segajo do enega metra pri ljudeh. Kinezinsko voden anterogradni transport zagotavlja pravočasno dostavo sinaptičnih komponent, mitohondrijev in drugih esencialnih organelov v distalna območja nevrona. Motnje pri delovanju kinezina lahko vodijo v pomanjkljivosti sinaptičnega prenosa, aksalne degeneracije in so bile povezane z več nevrodegenerativnimi boleznimi, vključno z Alzheimerjevo boleznijo in amiotrofično lateralno sklerozo (ALS). Pomembnost transporta, ki ga vodijo kinezini, pri zdravju nevronov poudarjajo raziskave vodilnih znanstvenih organizacij, kot so Nacionalni inštituti za zdravje in Nacionalni inštitut za nevrološke motnje in udarce, ki so izpostavili povezavo med okvarami aksalnega transporta in nevrodegeneracijo.
Poleg anterogradnega transporta se kinezini usklajujejo tudi z dynein motorji, ki posredujejo retrogradni transport (od aksonalne terminale nazaj do sroma), da ohranijo bidirekcijski pretok materialov, potrebnih za nevronalno homeostazo. Natančna regulacija aktivnosti kinezina, izbora tovora in usklajevanja z drugimi motornicami je predmet ongoing raziskav, z vplivi na razumevanje molekularne osnove nevronalnega povezovanja, plastičnosti in bolezni.
Konstrukcijska analiza: Kinesin proti dyneinu in miozinu
Kinezinske motorne beljakovine so temeljna klasa molekularnih motorjev, ki igrajo ključno vlogo pri intracelularnem transportu, zlasti po mikrocevkah. Da bi v celoti razumeli njihovo biološko pomembnost, je potrebno primerjati kinezine z obema ostalima velikima družinama citoskeletnih motornih beljakovin: dyneinami in miozini. Vsak od teh motornih beljakovin je specializiran za gibanje po različni citoskeletni filamenti in je prilagojen za specifične celične funkcije.
Kinezini in dyneini prečkajo mikrocevk, vendar se razlikujejo po svoji usmerjenosti in specifičnosti tovora. Kinezini se običajno gibljejo proti plus koncu mikrocevk, ki je običajno usmerjen proti celici obrobju, kar olajša anterogradni transport organelov, veziklov in beljakovinskih kompleksov. Po drugi strani se dyneini gibljejo proti minus koncu mikrocevk, kar usmerja tovor proti središču celice, kot so jedro ali organizacijski center mikrocevk. Ta bidirekcijski sistem zagotavlja učinkovito distribucijo in recikliranje celičnih komponent. Strukturno so kinezini običajno homodimerne ali heterodimerne beljakovine z dvema motornima domenama, medtem ko so citoplazemski dyneini veliki kompleksi z več podenotami, ki imajo bolj zapleten mehanizem generacije sile in regulacije (Nacionalni inštitut genetike).
Miozini, po drugi strani, so predvsem motorne beljakovine na osnovi aktina. Najbolj znani so po svoji vlogi v mišični kontrakciji, vendar sodelujejo tudi v različnih nemišičnih celičnih procesih, kot so citokineza, transport veziklov in celična gibljivost. Za razliko od kinezina in dyneina, ki se premikajo po mikrocevkah, miozini prečkajo aktinske filamente, običajno proti plus (barvanem) koncu. Strukturna organizacija miozinov je edinstvena, z značilno glavno domeno, ki se veže na aktin in hidrolizira ATP, s predelom vratu in repom, ki določa specifičnost tovora (Nacionalni inštituti za zdravje).
Funkcionalno so tri družine motornih beljakovin prilagojene svojim ustreznim citoskeletnim sledem in celičnim vlogam. Kinezini so ključni za dolgodistenski, usmerjen transport v nevronih in celicah, medtem ko so dyneini bistveni za retrogradni transport in ciliarno/flagelano gibanje. Miozini, nasprotno, so ključni pri procesih, ki zahtevajo generacijo sile in kratkodistični transport po aktinskih mrežah. Medsebojno delovanje teh motorjev zagotavlja dinamično organizacijo in prilagodljivost evkariontske celice.
Na kratko, medtem ko kinezini, dyneini in miozini delijo temeljno lastnost pretvarjanja kemijske energije iz hidrolize ATP v mehansko delo, so specializirani za različne tirnice, usmeritve in celične funkcije. Njihove usklajene aktivnosti so ključne za ohranjanje celične arhitekture, signalizacije in homeostaze.
Bolezni, povezane s kinezini, in terapevtski cilji
Kinezinske motorne beljakovine so bistveni molekularni stroji, ki prenašajo različne celične tovore po mikrocevkah, pri čemer igrajo ključno vlogo pri intracelularnem transportu, mitozah in nevronalni funkciji. Disregulacija ali mutacije genov kinezina so bile povezane s številnimi človeškimi boleznimi, kar te beljakovine dela pomembne tako kot biometerne označevalce kot tudi potencialne terapevtske cilje.
Ena izmed najbolje dokumentiranih povezav bolezni vključuje člana družine kinezina KIF1A. Mutacije v genu KIF1A so povezane s spektrum nevrodegenerativnih motenj, kolektivno imenovanih KIF1A-povezana nevrološka motnja (KAND). Te razmere se manifestirajo kot intelektualna invalidnost, spastična paraplegija in progresivna nevrodegeneracija. Osnova patologije je pogosto pripisati okvarjenemu aksalnemu transportu, ki moti sinaptično funkcijo in preživetje nevronov. Podobno so mutacije v drugih genih kinezina, kot sta KIF5A in KIF21A, povezane z dedno spastično paraplegijo in kongenitalno fibrozo ekstraokularnih mišic, kar dodatno poudarja ključno vlogo kinezina za zdravje živčnega sistema.
Poleg nevrodegeneracije so kinezinske motorne beljakovine vključene tudi v raka. Na primer, KIF11 (znan tudi kot Eg5) je ključen za oblikovanje mitotskega vretena med celično delitvijo. Prekomerna izraženost ali hiperaktivnost KIF11 je bila opažena v različnih rakih, vključno z rakom dojk in prostate, kjer prispeva k nekontrolirani proliferaciji celic. Zaradi tega je KIF11 izpostavljen kot obetaven cilj za protivnetne terapevtske terapije. Več majhnih molekulskih inhibitorjev KIF11, kot je ispinesib, je vstopilo v klinična preskušanja, z namenom, da selektivno motijo delitev rakavih celic, hkrati pa ohranjajo normalne celice. Razvoj in ocena teh inhibitorjev se natančno spremljata s strani regulativnih in raziskovalnih organizacij, kot je Nacionalni inštitut za rak in ameriška uprava za hrano in zdravila.
Terapevtske strategije, ki ciljajo na kinezinske motorne beljakovine, segajo tudi izven onkologije. V nevrodegenerativnih boleznih se opravljajo prizadevanja za razvoj molekul, ki lahko obnovijo ali modulirajo funkcijo kinezina, kar bi lahko zmanjšalo pomanjkljivosti aksalnega transporta. Poleg tega raziskave, ki jih podpirajo organizacije, kot so Nacionalni inštituti za zdravje, raziskujejo gensko terapijo in majhne molekulske pristope za popravljanje ali kompenzacijo za okvarjeno aktivnost kinezina v genetskih motnjah.
Na kratko, kinezinske motorne beljakovine so osrednje za celično zdravje, njihova disfunkcija pa je povezana s številnimi boleznimi, zlasti v živčnem sistemu in raku. Neprekinjena raziskava in klinični razvoj še naprej raziskujejo kinezine kot biometerne označevalce in terapevtske cilje, s potencialom, da prinesejo nove zdravljenje za trenutno nevzdržne razmere.
Nadobudne raziskave in prihodnje smeri
Nadobudne raziskave o kinezinskih motornih beljakovinah hitro širijo naše razumevanje njihovih vlog v celičnih procesih in njihovih potencialnih aplikacij v biotehnologiji in medicini. Kinezini so superfamilija ATP-odvisnih molekularnih motorjev, ki transportirajo tovor po mikrocevkah ter igrajo ključno vlogo v intracelularnem transportu, mitozah in nevronalni funkciji. Nedavne napredke v visokoločljivostni sliki in enomolekulski biofiziki so omogočili raziskovalcem, da vizualizirajo dinamiko kinezina v brezprecedenčnem natančnem obsegu, razkrivajo nove vpoglede v njihove mehanokemične cikle in regulativne mehanizme.
Ena obetavna smer vključuje razjasnitev strukturne raznolikosti kinezina in njenih posledic za specifičnost tovora in regulacijo. Tehnike strukturne biologije, kot je krio-elektronska mikroskopija, so razkrile edinstvene konformacijske države kinematičnih članov družine, kar pomeni specializirano prilagoditev za različne celične naloge. To strukturno znanje obvešča o zasnovi majhnih molekul in peptidov, ki lahko modulirajo aktivnost kinezina, kar ima potencialne terapevtske aplikacije v nevrodegenerativnih bolezni in raku, kjer je nepravilno delovanje kinezina vključeno v patogenezo.
Sintetična biologija prav tako izkorišča kinezinske motorje za inženiring transportnih sistemov na nanoskalni ravni. Z izkoriščanjem usmerjenega gibanja kinezina razvijajo raziskovalci biomimetične naprave za ciljni prenos zdravil in molekulsko sestavljanje. Te inovacije bi lahko revolucionirale natančno medicino z omogočanjem nadzorovanega transporta terapevtskih agensov znotraj celic ali tkiv.
Drugo hitro rastoče področje je raziskovanje vloge kinezina pri zdravju in bolezni nevronov. Mutacije v genih kinezina so povezane z dedno spastično paraplegijo, Charcot-Marie-Toothovo boleznijo in drugimi nevrodegenerativnimi motnjami. Nadaljne raziskave si prizadevajo razjasniti, kako te mutacije motijo aksalni transport, in prepoznati strategije za obnovo normalne funkcije. Nacionalni inštituti za zdravje in Nacionalni inštitut za nevrološke motnje in udarce podpirajo pobude za preučevanje molekularnih temeljev teh bolezni in razvoj ciljnih intervencij.
V prihodnje se pričakuje, da bo integracija računalniškega modeliranja, napredne mikroskopije in tehnologij urejanja genoma pospešila odkritja v biologiji kinezina. Sodelovalne pobude med akademskimi institucijami, vladnimi agencijami in biotehnološkimi podjetji spodbujajo prevod osnovnih raziskav v klinične in industrijske aplikacije. Ko se naše razumevanje kinezinskih motornih beljakovin poglablja, se bodo pojavile nove možnosti za manipulacijo intracelularnega transporta, diagnosticiranje bolezni in oblikovanje inovativnih terapevtskih strategij.
Viri in reference
- Nacionalni inštituti za zdravje
- Nature Publishing Group
- Evropski laboratorij za molekularno biologijo
- Nacionalna znanstvena fundacija
- Evropska organizacija za molekularno biologijo
- Nacionalni inštitut genetike
- Nacionalni inštitut za raka