Kinesinmotorproteiner: De dynamiska motorerna som driver intracellär logistik. Upptäck hur dessa molekylära maskiner revolutionerar cellens funktion och hälsa.
- Introduktion till kinesinmotorproteiner
- Molekylär struktur och verkningsmekanism
- ATP-hydrolys och energiöverföring
- Lastigenkänning och bindningsspecificitet
- Intracellulära transportvägar
- Reglering av kinesinaktivitet
- Kinesin i neuronal funktion och axonal transport
- Jämförande analys: Kinesin vs. Dynein och Myosin
- Kinesinrelaterade sjukdomar och terapeutiska mål
- Framväxande forskning och framtida riktningar
- Källor & Referenser
Introduktion till kinesinmotorproteiner
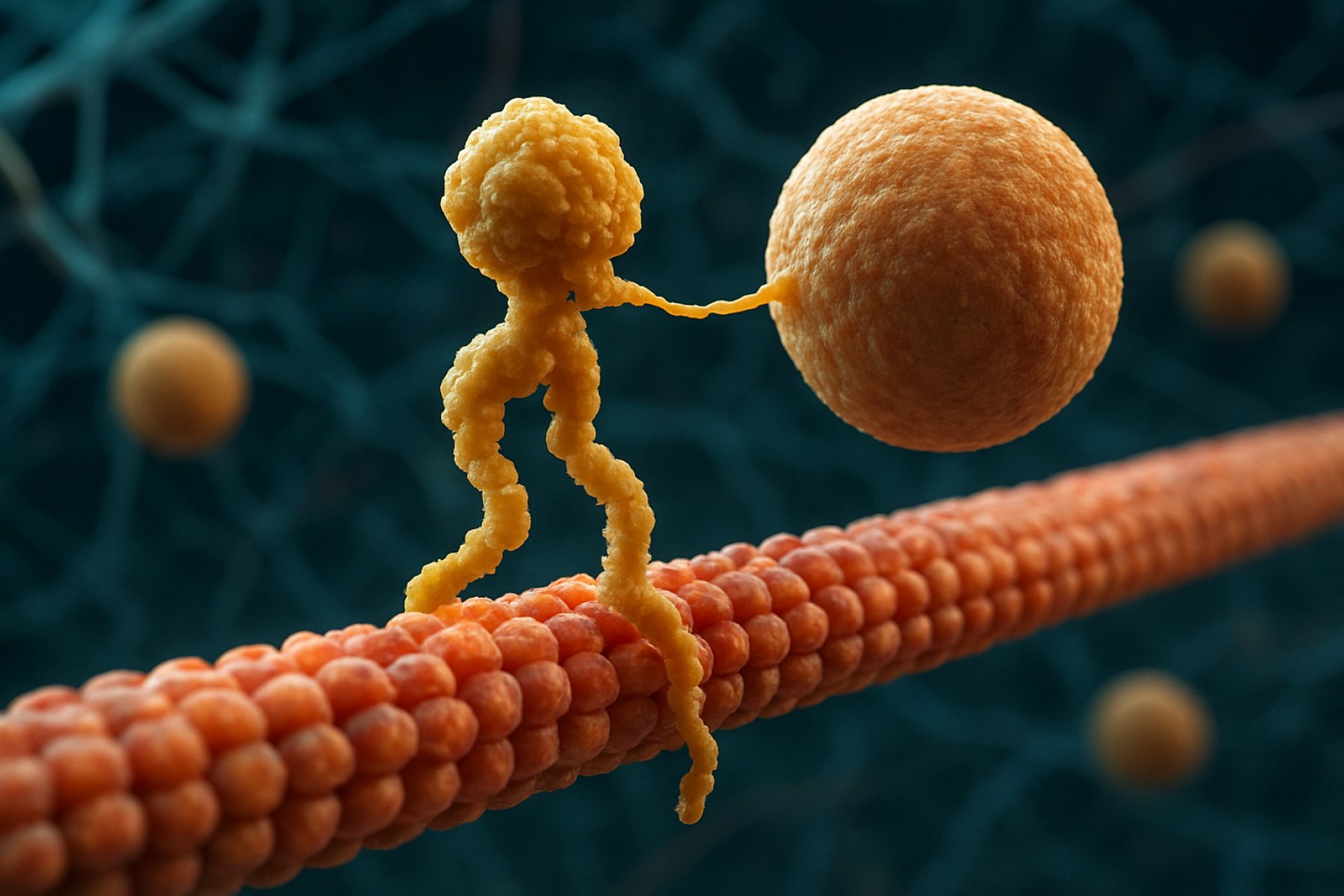
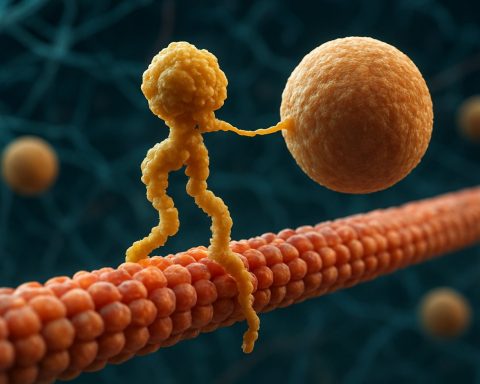
Kinesinmotorproteiner är en grundläggande klass av molekylära motorer som spelar en kritisk roll i intracellulär transport och cellular organisation. Upptäckta i mitten av 1980-talet är kinesiner ATP-beroende proteiner som rör sig längs mikrotubuli i eukaryota celler och transporterar en mängd olika laster såsom organeller, vesiklar, proteiner och mRNA. Denna transport är avgörande för flera cellulära processer, inklusive mitos, meios och neuronal funktion. Kinesinfamiljen är stor och varierad, med över 40 olika kinesin-gener identifierade hos människor, var och en kodande för proteiner med specialiserade funktioner och lasternas specificiteter.
Strukturellt sett består kinesiner vanligtvis av två tunga kedjor och två lätta kedjor. De tunga kedjorna innehåller ett bevarat motorområde som binder till mikrotubuli och hydrolyserar ATP för att generera rörelse. Svansdomänerna hos kinesiner är ansvariga för lastbindning, vilket gör att motorn kan transportera specifika cellulära komponenter till sina avsedda destinationer. Kinesiners rörelse riktas generellt mot plusänden av mikrotubuli, vilket vanligtvis motsvarar cellens perifer, även om vissa medlemmar av kinesinfamiljen rör sig mot minusänden.
Verkningsmekanismen för kinesinrörelse beskrivs ofta som en ”hand-över-hand” gående rörelse, där de två motorområdena växelvis binder och släpper mikrotubuli, drivet av cykler av ATP-bindning och hydrolys. Denna processiva rörelse gör det möjligt för kinesiner att färdas långa avstånd längs mikrotubuli utan att lossa, vilket gör dem till mycket effektiva transportörer inom den trånga cellulära miljön. Den exakta regleringen av kinesinaktivitet är avgörande för att upprätthålla cellulär homeostas och funktion.
Kinesinmotorproteiner är inte bara vitala för normala cellulära operationer utan är också involverade i olika sjukdomar. Defekter i kinesinfunktionen har kopplats till neurodegenerativa sjukdomar, såsom Alzheimers sjukdom och ärftlig spastisk paraplegi, samt vissa cancerformer. Som ett resultat är kinesiner föremål för intensiv forskning, både för att förstå deras grundläggande biologi och för att utforska deras potential som terapeutiska mål.
Forskning om kinesinmotorproteiner stöds och främjas av ledande vetenskapliga organisationer och forskningsinstitut världen över, inklusive National Institutes of Health och Nature Publishing Group, som regelbundet publicerar peer-reviewed studier om strukturen, funktionen och den biomedicinska betydelsen av dessa proteiner. Den pågående studien av kinesiner fortsätter att avslöja nya insikter i livets molekylära maskineri och erbjuder lovande vägar för utveckling av nya medicinska interventioner.
Molekylär struktur och verkningsmekanism
Kinesinmotorproteiner är en superfamilj av ATP-beroende molekylära motorer som spelar en avgörande roll i intracellulär transport, särskilt längs mikrotubuli. Strukturellt sett består kinesiner vanligtvis av två tunga kedjor och två lätta kedjor, vilket bildar en heterotetramer komplex. De tunga kedjorna innehåller ett mycket bevarat N-terminalt motorområde (även kallat ”huvud”), en vriden hals och en C-terminal svansdomän. Motorområdet är ansvarigt för bindning till mikrotubuli och hydrolys av ATP, vilket ger den energi som krävs för rörelse. Svansdomänen å sin sida är involverad i lastigenkänning och bindning och interagerar ofta med adaptorproteiner eller direkt med vesiklar och organeller.
Verkningsmekanismen för kinesinmotorproteiner beskrivs ofta som en ”hand-över-hand” gåande rörelse. Varje kinesinmolekyl har två motorområden som växelvis binder till och släpper mikrotubuli, koordinerade av ATP-bindning och hydrolys. När ett huvud binder till mikrotubuli och hydrolyserar ATP genomgår det en konformationsförändring som driver det andra huvudet framåt till nästa bindningsställe, cirka 8 nanometer bort. Denna process upprepas, vilket gör att kinesinen kan ”gå” unidirectionellt längs mikrotubuli, vanligtvis mot plusänden, som är orienterad mot cellens perifer. Den koordinerade rörelsen av de två huvuden säkerställer processivitet, vilket innebär att kinesinen kan ta många steg längs en mikrotubuli utan att dissociera, vilket är avgörande för effektiv lasttransport över långa avstånd inom cellen.
Kinesiner är mycket varierade, med över 40 olika kinesin-gener identifierade hos människor, var och en anpassad för specifika cellulära funktioner. Medan de flesta kinesiner rör sig mot mikrotubulins plusända, rör sig vissa, såsom kinesin-14 familjemedlemmar, mot minusänden, vilket framhäver den funktionella mångsidigheten inom denna proteinfamilj. Aktiviteten och riktningen för kinesiner bestäms av subtila skillnader i deras motorområden och associerade regleringsregioner.
Studien av kinesinstruktur och funktion har främjats av högupplösta tekniker såsom röntgenkristallografi och cryo-elektronmikroskopi, som har avslöjat detaljerade insikter i de konformationsförändringar som ligger till grund för deras motilitet. Dessa fynd har varit avgörande för att förstå inte bara grundläggande cellbiologi utan också den molekylära grunden för sjukdomar som är kopplade till kinesindysfunktion, såsom vissa neurodegenerativa sjukdomar och cancer. Ledande forskningsorganisationer, inklusive National Institutes of Health och European Molecular Biology Laboratory, fortsätter att undersöka de molekylära mekanismerna för kinesinmotorproteiner, vilket understryker deras grundläggande betydelse inom cellbiologi.
ATP-hydrolys och energiöverföring
Kinesinmotorproteiner är viktiga molekylära maskiner som omvandlar kemisk energi till mekaniskt arbete, vilket möjliggör transport av olika cellulära laster längs mikrotubuli. Den grundläggande processen som ligger till grund för denna rörelse är hydrolys av adenosintrifosfat (ATP), vilket ger den energi som krävs för kinesinens konformationsförändringar och riktad motilitet.
ATP-hydrolys sker vid motorområdena (även kallade ”huvuden”) av kinesindimerer. Varje huvud innehåller en starkt bevarad nukleotidbindande plats som växelvis binder och hydrolyserar ATP. Den mekanokemiska cykeln börjar när ett kinesinhuvud, som är hårt bundet till mikrotubuli, binder ATP. Denna bindning inducerar en konformationsförändring i halslänkregionen, vilket för fram det efterföljande huvudet i en ”hand-över-hand” rörelse. När det ledande huvudet binder till den nästa tubulinsuben hydrolyseras ATP till adenosindifosfat (ADP) och oorganiskt fosfat (Pi), vilket frigör energi som omvandlas till mekanisk rörelse. Frigörandet av Pi och efterföljande utbyte av ADP mot ATP återställer cykeln, vilket möjliggör kontinuerlig processiv rörelse längs mikrotubuli.
Effektiviteten av energiöverföring i kinesin är anmärkningsvärd. Varje ATP-molekyl som hydrolyseras resulterar i ett 8-nanometers steg längs mikrotubuli, med minimal energiförlust. Denna höga effektivitet beror på det täta sambandet mellan ATP-hydrolys och den mekaniska stegmekanismen. Processen är starkt reglerad, vilket säkerställer att ATP-hydrolys endast inträffar när kinesinhuvudet är ordentligt engagerat med mikrotubuli, vilket förhindrar slöseri med energi.
Kinesins ATPasaktivitet moduleras också av närvaron av last och den specifika typen av kinesinfamiljemedlem som är involverad. Till exempel är den konventionella kinesin-1 mycket processiv, kapabel att ta hundratals steg utan att dissociera från mikrotubuli, medan andra kinesinfamiljemedlemmar kan ha olika ATP-hydrolyshastigheter och stegbeteenden, anpassade till sina cellulära funktioner.
Studien av ATP-hydrolys och energiöverföring i kinesin har varit avgörande för att förstå intracellulära transportmekanismer och de bredare principerna för molekylära motorers funktion. Forskning inom detta område stöds av ledande vetenskapliga organisationer såsom National Institutes of Health och National Science Foundation, som finansierar undersökningar av den strukturella biologin och biofysiken av motorproteiner. Insikter som erhållits från dessa studier har implikationer för neurobiologi, cellindelning och utveckling av nanoteknologiska tillämpningar som efterliknar biologiska motorer.
Lastigenkänning och bindningsspecificitet
Kinesinmotorproteiner är viktiga molekylära maskiner som transporterar en mängd olika intracellulära laster längs mikrotubuli, och spelar en avgörande roll i processer som organellplacering, vesikeltransport och mitos. Specificiteten med vilken kinesiner känner igen och binder till sin last är grundläggande för noggrannheten och regleringen av intracellulär transport. Denna specificitet uppnås genom en kombination av strukturella egenskaper, adaptorproteiner och regleringsmekanismer.
Kinesinfamiljen kännetecknas av ett bevarat motorområde ansvarigt för ATP-hydrolys och bindning till mikrotubuli, men funktionerna för lastigenkänning och bindning medieras främst av de variabla svansdomänerna. Dessa svansregioner skiljer sig avsevärt mellan kinesinfamiljemedlemmarna, vilket möjliggör selektiv interaktion med olika laster. Till exempel använder kinesin-1 (även känd som konventionell kinesin) sin C-terminala svans för att binda till en mängd laster, inklusive membranbindande organeller och vesiklar, ofta genom adaptorproteiner som kinesinläggenheter (KLC). KLC:er innehåller tetratrikopeptidrepeatur (TPR) motiv som underlättar igenkänningen av specifika lastassocierade proteiner, vilket därigenom ger selektivitet till transportprocessen.
Adaptorproteiner spelar en avgörande roll i att koppla kinesiner till sina laster. Dessa adaptorproteiner kan känna igen specifika signaler eller motiv på lastens yta, vilket säkerställer att endast den lämpliga lasten transporteras av en given kinesin. Till exempel är interaktionen mellan KLC:er och JIP (c-Jun N-terminal kinasinteragerande protein) familjemedlemmar väldokumenterad i neuronal transport, där JIP:arna fungerar som stödpunkter som kopplar kinesin-1 till vesiklar som innehåller signalmolekyler. Andra kinesinfamiljemedlemmar, såsom kinesin-3, använder olika adaptorproteiner och svansdomänstrukturer för att uppnå lastspecificitet, vilket återspeglar den mångfald av laster och cellulära sammanhang där kinesiner verkar.
Regleringen av lastbindning uppnås också genom post-translationella modifieringar och konkurrensinteraktioner. Fosforylering av kinesinsvansar eller adaptorproteiner kan modulera bindningsaffiniteten, vilket möjliggör dynamisk kontroll över lastkoppling och frisättning som svar på cellulära signaler. Dessutom kan vissa laster konkurrera om att binda till samma kinesin, vilket introducerar ett annat lager av reglering som säkerställer korrekt lastfördelning.
Studien av lastigenkänning och bindningsspecificitet hos kinesinmotorproteiner är ett snabbt utvecklande område, med implikationer för att förstå neurodegenerativa sjukdomar, intracellulära transportstörningar och utvecklingen av riktade terapier. Ledande forskningsorganisationer som National Institutes of Health och European Molecular Biology Organization stöder pågående undersökningar av de molekylära mekanismerna bakom kinesin-lastinteraktioner, vilket framhäver den biomedicinska betydelsen av detta område.
Intracellulära transportvägar
Kinesinmotorproteiner är viktiga molekylära maskiner som driver intracellulär transport längs mikrotubuli, vilket säkerställer exakt leverans av organeller, vesiklar, proteiner och andra laster inom eukaryota celler. Dessa ATP-beroende motorer kännetecknas av sin förmåga att konvertera kemisk energi till mekaniskt arbete, vilket underlättar rörelsen av cellulära komponenter över långa avstånd med anmärkningsvärd riktning och specificitet.
Strukturellt sett består kinesiner vanligtvis av två tunga kedjor som bildar en dimer, var och en med ett globulärt motorområde (huvud) som binder till mikrotubuli och hydrolyserar ATP. Svansdomänerna är ansvariga för lastigenkänning och bindning, ofta i samverkan med lätta kedjor eller adaptorproteiner. Den mest studerade medlemmen, kinesin-1, rör sig främst mot plusänden av mikrotubuli, vilket vanligtvis motsvarar cellens perifer, och därmed spelar en avgörande roll i anterograd transport.
Verkningsmekanismen för kinesinrörelse beskrivs ofta som en ”hand-över-hand” gående rörelse, där de två motorområdena växelvis binder och kliver längs mikrotubuli-strukturen. Varje steg är tätt kopplat till hydrolysen av en enda ATP-molekyl, vilket säkerställer processivitet och riktning. Denna koordinerade rörelse gör det möjligt för kinesiner att transportera laster över avstånd som kan omfatta hela längden av en neuron eller andra stora celltyper.
Kinesiner klassificeras i flera familjer baserat på sekvenshomologi och funktionell specialisering. Medan kinesin-1 främst är involverad i transport av organeller och vesiklar, har andra familjer som kinesin-2 och kinesin-3 distinkta roller inom cilietransport och synaptisk vesikeltrafik, respektive. Vissa kinesiner, som kinesin-5, är involverade i dynamiken hos mitotiska spolar snarare än lasttransport, vilket framhäver den funktionella mångfalden inom denna proteinsuperfamilj.
Aktiviteten hos kinesinmotorer regleras noggrant av cellulära signalvägar, post-translationella modifieringar och interaktioner med mikrotubuli-associerade proteiner. Denna reglering säkerställer att laster levereras till rätt subcellulära platser som svar på fysiologiska behov. Störningar i kinesinmedierad transport har kopplats till olika sjukdomar, inklusive neurodegenerativa sjukdomar, där defekt axonal transport bidrar till neuronal dysfunktion och degeneration.
Forskning om kinesinmotorproteiner fortsätter att öka vår förståelse för cellulär logistik och har inspirerat utvecklingen av biomimetiska nanoutrustningar. Ledande vetenskapliga organisationer såsom National Institutes of Health och Nature Publishing Group publicerar regelbundet grundläggande studier och översikter om strukturen, funktionen och den biomedicinska betydelsen av kinesinmotorer, vilket betonar deras centrala roll inom cellbiologi.
Reglering av kinesinaktivitet
Kinesinmotorproteiner är viktiga molekylära maskiner som transporterar laster längs mikrotubuli inom eukaryota celler. Regleringen av kinesinaktivitet är avgörande för att upprätthålla cellulär organisation, säkerställa korrekt fördelning av organeller och stödja processer som mitos och neuronal funktion. Flera nivåer av reglering finns för att kontrollera när, var och hur kinesiner interagerar med sina laster och mikrotubuli.
En primär mekanism för reglering är genom autoinhibition. Många medlemmar av kinesinfamiljen, som kinesin-1, har svansdomäner som kan vika tillbaka och interagera med sina motorområden, vilket förhindrar ATPasaktivitet och bindning till mikrotubuli i avsaknad av last. Denna autoinhiberade konformation lindras vid lastbindning, vilket inducerar en konformationsförändring som aktiverar motorn för processiv rörelse. Denna mekanism säkerställer att kinesiner endast är aktiva när det behövs, vilket förhindrar onödig ATP-förbrukning och potentiell cellskada.
Post-translationella modifieringar (PTMs) spelar också en betydande roll i att modulera kinesinaktivitet. Fosforylering är den mest omfattande studerade PTM, där kinaser som cyklinberoende kinaser (CDK) och glykogen syntas kinas 3 (GSK3) fosforylerar specifika restprodukter på kinesinproteiner. Dessa modifieringar kan antingen förstärka eller hämma motoraktivitet, beroende på sammanhanget och den specifika kinesin som är involverad. Till exempel, fosforylering av kinesin-1 av GSK3 inhiberar dess förmåga att binda till mikrotubuli, vilket därmed reglerar axonal transport i neuroner.
Lastadapterproteiner finslipar vidare regleringen av kinesin. Dessa adaptorproteiner, såsom JIP1 och Milton, kopplar kinesiner till specifika laster och kan modulera motoraktivitet genom att stabilisera den aktiva konformationen eller rekrytera ytterligare regleringsfaktorer. Samverkan mellan adaptorproteiner och motorer möjliggör precis spatial och temporär kontroll av lastleverans, vilket är särskilt kritiskt i högpolära celler som neuroner.
Dessutom kan mikrotubulis spår själva påverka kinesinaktivitet. Mikrotubuli-associerade proteiner (MAPs) och post-translationella modifieringar av tubulin (såsom acetylering eller detyrosinering) kan förändra bindningsaffiniteten och motiliteten hos kinesiner, vilket effektivt guidar eller begränsar deras rörelse längs specifika subset av mikrotubuli.
Regleringen av kinesinmotorproteiner är ett ämne för pågående forskning, med implikationer för att förstå neurodegenerativa sjukdomar, cancer och utvecklingsstörningar. Ledande organisationer som National Institutes of Health och Nature Publishing Group stöder och sprider forskning inom detta område, vilket understryker betydelsen av kinesinreglering inom hälsa och sjukdom.
Kinesin i neuronal funktion och axonal transport
Kinesinmotorproteiner är en superfamilj av ATP-beroende molekylära motorer som spelar en avgörande roll i intracellulär transport, särskilt inom den högt polariserade miljön hos neuroner. Dessa proteiner rör sig längs mikrotubuli och omvandlar kemisk energi från ATP-hydrolys till mekaniskt arbete, vilket möjliggör den riktade rörelsen av olika cellulära laster. I neuroner är kinesiner avgörande för transport av organeller, synaptiska vesikelprekursorer, proteiner och mRNAs från cellkroppen (soma) till axonterminalen, en process känd som anterograd axonal transport.
Kinesinfamiljen är mångsidig, med över 40 olika kinesin-gener identifierade hos människor, var och en kodande för proteiner med specialiserade funktioner och lasternas specificiteter. Den mest välkarakteriserade medlemmen, kinesin-1 (även känd som konventionell kinesin), är en heterotetramer som består av två tunga kedjor och två lätta kedjor. De tunga kedjorna innehåller motorområdena ansvariga för ATP-hydrolys och bindning till mikrotubuli, medan de lätta kedjorna medierar lastigenkänning och bindning. Denna strukturella organisation gör det möjligt för kinesin-1 att transportera en mängd olika laster som är kritiska för neuronal funktion och överlevnad.
Axonal transport är avgörande för att upprätthålla neuronal hälsa och funktion, med tanke på den extrema längden av vissa axoner, som kan sträcka sig upp till en meter hos människor. Kinesindriven anterograd transport säkerställer den tidsenliga leveransen av synaptiska komponenter, mitokondrier och andra viktiga organeller till distala områden av neuronen. Störning av kinesinfunktionen kan leda till brister i synaptisk överföring, axonal degeneration och har kopplats till flera neurodegenerativa sjukdomar, inklusive Alzheimers sjukdom och amyotrof lateral skleros (ALS). Betydelsen av kinesinmedierad transport i neuronal hälsa understryks av forskning från ledande vetenskapliga organisationer som National Institutes of Health och National Institute of Neurological Disorders and Stroke, som har belyst kopplingen mellan axonal transportdefekter och neurodegenerering.
Utöver anterograd transport samordnar kinesiner också med dyneinmotorproteiner, som medierar retrograd transport (från axonterminalen tillbaka till soma), för att upprätthålla det bi-direktionella flödet av material som är nödvändigt för neuronal homeostas. Den exakta regleringen av kinesinaktivitet, val av last och samordning med andra motorproteiner är ett ämne för pågående forskning, med implikationer för att förstå den molekylära grunden för neuronal koppling, plasticitet och sjukdom.
Jämförande analys: Kinesin vs. Dynein och Myosin
Kinesinmotorproteiner är en grundläggande klass av molekylära motorer som spelar en kritisk roll i intracellulär transport, särskilt längs mikrotubuli. För att fullt ut förstå deras biologiska betydelse är det nödvändigt att jämföra kinesiner med de andra två stora familjerna av cytoskelettmotorproteiner: dyneiner och myosiner. Var och en av dessa motorproteiner är specialiserade för rörelse längs distinkta cytoskelettfilament och är anpassade för specifika cellulära funktioner.
Kinesiner och dyneiner korsar båda mikrotubuli, men de skiljer sig åt i deras riktning och lastspecificitet. Kinesiner rör sig vanligtvis mot plusänden av mikrotubuli, som vanligtvis är orienterad mot cellens perifer, vilket underlättar anterograd transport av organeller, vesiklar och proteincomplex. I kontrast rör sig dyneiner mot minusänden av mikrotubuli, vilket riktar lasten mot cellens centrum, såsom kärnan eller mikrotubuli-organiseringscentret. Detta bi-direktionella system säkerställer effektiv distribution och återvinning av cellulära komponenter. Strukturellt sett är kinesiner vanligtvis homodimeriska eller heterodimeriska proteiner med två motorområden, medan cytoplasmatiska dyneiner är stora, multi-subenhetskomplex med en mer intrikat mekanism för kraftgenerering och reglering (National Institute of Genetics).
Myosiner, å sin sida, är primärt aktinbaserade motorproteiner. De är mest kända för sin roll i muskelkontraktion, men de deltar också i en rad olika icke-muskulära cellulära processer, såsom cytokinesis, vesikeltransport och cellmotilitet. Till skillnad från kinesiner och dyneiner, som rör sig längs mikrotubuli, korsar myosiner aktinfilament, vanligtvis mot plus (barbed) änden. Den strukturella organisationen av myosiner är distinkt, med ett karaktäristiskt huvudområde som binder till aktin och hydrolyserar ATP, ett halsområde och en svans som bestämmer lastspecificitet (National Institutes of Health).
Funktionellt är de tre motorproteinfamiljerna anpassade till sina respektive cytoskelettspår och cellulära roller. Kinesiner är avgörande för långdistans, riktad transport i neuroner och delande celler, medan dyneiner är nödvändiga för retrograd transport och cilie-/flagellantester. Myosiner, å sin sida, är centrala för processer som kräver kraftgenerering och kortdistanstransport på aktinnätverk. Samverkan mellan dessa motorer säkerställer den dynamiska organiseringen och anpassningsförmågan hos den eukaryota cellen.
Sammanfattningsvis, medan kinesiner, dyneiner och myosiner delar den grundläggande egenskapen att omvandla kemisk energi från ATP-hydrolys till mekaniskt arbete, är de specialiserade för olika spår, riktningar och cellulära funktioner. Deras samordnade handlingar är avgörande för att upprätthålla cellulär arkitektur, signalering och homeostas.
Kinesinrelaterade sjukdomar och terapeutiska mål
Kinesinmotorproteiner är viktiga molekylära maskiner som transporterar olika cellulära laster längs mikrotubuli, vilket spelar en avgörande roll i intracellulär trafik, mitos och neuronal funktion. Dysreglering eller mutation av kinesin-gener har kopplats till en rad mänskliga sjukdomar, vilket gör dessa proteiner betydelsefulla både som biomarkörer och som potentiella terapeutiska mål.
En av de mest väl dokumenterade kopplingarna till sjukdomar involverar kinesinfamiljemedlemmen KIF1A. Mutationer i KIF1A-genen är kopplade till ett spektrum av neurodegenerativa sjukdomar, gemensamt benämnda KIF1A-associerad neurologisk sjukdom (KAND). Dessa tillstånd manifesterar sig som intellektuell funktionsnedsättning, spastisk paraplegi och progressiv neurodegeneration. Den underliggande patologin tillskrivs ofta nedsatt axonal transport, vilket stör synaptisk funktion och neuronal överlevnad. På liknande sätt har mutationer i andra kinesin-gener, såsom KIF5A och KIF21A, kopplats till ärftlig spastisk paraplegi och medfödd fibros i extraockulära muskler, vilket ytterligare understryker den kritiska rollen för kinesiner i nervsystemets hälsa.
Utöver neurodegeneration är kinesinmotorproteiner också involverade i cancer. Till exempel är KIF11 (även känd som Eg5) väsentlig för bildandet av mitotiska spolar under celldelningen. Överuttryck eller hyperaktivitet av KIF11 har observerats i olika cancerformer, inklusive bröst- och prostatacancer, där det bidrar till okontrollerad cellproliferation. Som ett resultat har KIF11 framträtt som ett lovande mål för anti-mitotiska cancermediciner. Flera småmolekylära inhibitorer av KIF11, såsom ispinesib, har kommit in i kliniska prövningar, med målet att selektivt störa cancer celldivision medan normala celler sparas. Utvecklingen och utvärderingen av dessa inhibitorer övervakas noggrant av regulatoriska och forskningsorganisationer som National Cancer Institute och U.S. Food and Drug Administration.
Therapeutiska strategier som riktar sig mot kinesinmotorproteiner sträcker sig bortom onkologi. Inom neurodegenerativa sjukdomar pågår ansträngningar för att utveckla molekyler som kan återställa eller modulera kinesinfunktionen, potentiellt mildra axonal transportbrister. Dessutom utforskar forskning som stöds av organisationer som National Institutes of Health genterapi och småmolekylära metoder för att korrigera eller kompensera för defekt kinesinaktivitet i genetiska störningar.
Sammanfattningsvis är kinesinmotorproteiner centrala för cellulär hälsa, och deras dysfunktion är kopplad till en mängd olika sjukdomar, särskilt i nervsystemet och i cancer. Pågående forskning och kliniska utvecklingsinsatser fortsätter att utforska kinesiner som både biomarkörer och terapeutiska mål, med potential att ge nya behandlingar för för närvarande svårbehandlade tillstånd.
Framväxande forskning och framtida riktningar
Framväxande forskning om kinesinmotorproteiner expanderar snabbt vår förståelse för deras roller i cellulära processer och deras potentiella tillämpningar inom bioteknik och medicin. Kinesiner är en superfamilj av ATP-beroende molekylära motorer som transporterar laster längs mikrotubuli och spelar väsentliga roller i intracellulär trafik, mitos och neuronal funktion. Nyligen har framsteg inom högupplöst imaging och enskilda molekylbiophysik gjort det möjligt för forskare att visualisera kinesindynamik i en aldrig tidigare skådad detalj, vilket avslöjar nya insikter i deras mekanokemiska cykler och regleringsmekanismer.
En lovande riktning handlar om att elucidare kinesinens strukturella mångfald och dess konsekvenser för lastspecifik och reglering. Strukturella biologitekniker, såsom cryo-elektronmikroskopi, har avslöjat distinkta konformationsstater av kinesinfamiljemedlemmar, vilket tyder på specialiserade anpassningar för olika cellulära uppgifter. Denna strukturella kunskap informerar designen av små molekyler och peptider som kan modulera kinesinaktivitet, med potentiella terapeutiska tillämpningar inom neurodegenerativa sjukdomar och cancer, där avvikande kinesinfunktion är kopplad till patogenes.
Syntetisk biologi utnyttjar också kinesinmotorer för att konstruera nanoskaliga transportsystem. Genom att utnyttja den riktade rörelsen hos kinesiner utvecklar forskare biomimetiska enheter för riktad läkemedelsleverans och molekylär sammansättning. Dessa innovationer kan revolutionera precisionsmedicin genom att möjliggöra kontrollerad transport av terapeutiska ämnen inom celler eller vävnader.
Ett annat framväxande område är studiet av kinesinens roll i neuronal hälsa och sjukdom. Mutationer i kinesingener har kopplats till ärftlig spastisk paraplegi, Charcot-Marie-Tooth sjukdom och andra neurodegenerativa störningar. Pågående forskning syftar till att klargöra hur dessa mutationer stör axonal transport och att identifiera strategier för att återställa normal funktion. National Institutes of Health och National Institute of Neurological Disorders and Stroke stöder initiativ för att undersöka de molekylära grundvalarna för dessa sjukdomar och att utveckla riktade interventioner.
Framöver förväntas integreringen av datorbaserade modeller, avancerad mikroskopi och genomredigeringsteknologier påskynda upptäckterna inom kinesinbiologi. Samarbetsinsatser mellan akademiska institutioner, statliga myndigheter och bioteknikföretag främjar övergången av grundforskning till kliniska och industriella tillämpningar. När vår förståelse av kinesinmotorproteiner fördjupas, kommer nya möjligheter att uppstå för att manipulera intracellulär transport, diagnostisera sjukdomar och designa innovativa terapeutiska strategier.
Källor & Referenser
- National Institutes of Health
- Nature Publishing Group
- European Molecular Biology Laboratory
- National Science Foundation
- European Molecular Biology Organization
- National Institute of Genetics
- National Cancer Institute